
【题目】如图为某原电池装置:

(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,则铁片为______极(填“正”或“负”),A极电极反应式为_______,是_______(填“氧化反应”或“还原反应”)。
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,放电时的方程式为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,则B极的电极反应式为_________,H+向__________(填“正”或“负”)极移动。
(3)若A、B均为Pt电极,电解质溶液为稀硫酸,则向A极通入H2, B极通入O2,B极的反应为:O2+4e-+4H+=2H2O,则A极的电极反应式为_____________。
【答案】负 Fe3++e-=Fe2+ 还原反应 Pb-2e-+SO42-=PbSO4 正 H2-2e-=2H+(或2H2-4e-=4H+)
【解析】
(1)若A为铜,B为铁,电解质溶液为Fe2(SO4)3溶液,Fe易失电子作负极、Cu作正极,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-=Fe2+,铁元素化合价降低,发生还原反应;
(2)若A为PbO2,B为Pb,电解质溶液为稀硫酸,根据放电时的方程式PbO2+Pb+2H2SO4=2PbSO4+2H2O,Pb失电子发生氧化反应,Pb为负极、PbO2为正极;则负极B的电极反应式为Pb-2e-+SO42-=PbSO4,原电池中阳离子移向正极,所以H+向正极移动;
(3) B极的反应为:O2+4e-+4H+=2H2O,则B发生还原反应,B为正极,A为负极,负极氢气失电子生成氢离子,负极反应式是H2-2e-=2H+。


科目:高中化学 来源: 题型:
【题目】科学家正在研究建立如图所示的二氧化碳新循环体系以解决日益加剧的温室效应等问题,关系图中能反映的化学观点或化学思想有( )
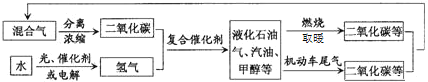
①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的
A.①②③B.①④⑤C.①②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,3-二异丙烯基苯的说法错误的是( )
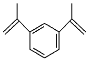
A.其一氯代物有6种
B.与液溴混合后加入铁粉可发生取代反应
C.分子中所有碳原子可能处于同一平面
D.能发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式包裹在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,则融化后的水为淡水。用NA表示阿伏加德罗常数的值,设冰的密度为0.9g/cm3。下列叙述正确的是

A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.冰的密度比水小是因为在固态冰中水分子间以氢键结合,排列更规整
D.每含1mol H2O的海冰内就有2×105 NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
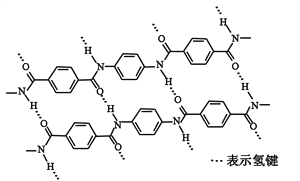
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
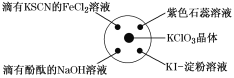
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
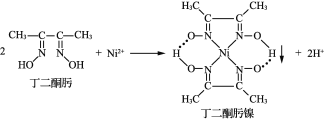
【题目】Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
(1)Ni2+基态核外电子排布式为___________。
(2)1mol丁二酮肟分子中含有σ键的数目为______mol。
(3)丁二酮肟镍分子中碳原子的杂化轨道类型为_____。
(4)Ni(CO)4是一种无色液体,沸点为43℃,熔点为-19.3 ℃。Ni(CO)4的晶体类型是____。
(5)与CO互为等电子体的二价阴离子为_____,Ni(CO)4中Ni与CO的C原子形成配位键,不考虑空间构型,Ni(CO)4的结构可用示意图表示为_____。
(6)下列离子的VSEPR模型与离子的空间立体构型一致的是_______。
A.SO32- B.ClO4- C.NO2- D.ClO3-
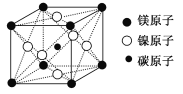
(7)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:

下列说法正确的是( )
A. 物质X在空气中不易被氧化
B. 物质Z的分子式为C13H14O3
C. 物质Y可以发生取代、加成、消去反应
D. 等物质的量的Y、Z分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com