
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
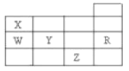
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素的非金属性比W元素的非金属性强
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】碳酸亚铁是白色难溶于水的固铁剂。某小组利用如图装置,向装置③中通入CO2至溶液pH=7,然后滴入FeSO4溶液,过滤、洗涤、干燥制得FeCO3。
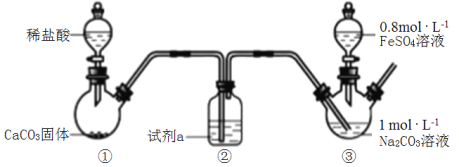
下列说法错误的是( )
A.试剂a是饱和NaHCO3溶液
B.碳酸钠溶液通入CO2至pH=7的目的是降低c(OH-),防止生成Fe(OH)2
C.装置③中生成沉淀的离子方程式为Fe2++CO![]() =FeCO3↓
=FeCO3↓
D.碳酸钠溶液显碱性的原因是CO![]() +H2OHCO
+H2OHCO![]() +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
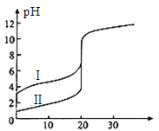
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-16 ,H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11, CH3COOH:Ka=1.8×10-5,HClO2:Ka=1.1×10-2,NH3·H2O:Kb=1.8×10-5。
(1)①常温下,0.1 mol·L-1Na2S溶液和0.1 mol·L-1Na2CO3溶液,碱性更强的是_____,其原因是_______。
②25 ℃时,CH3COONH4溶液显__性。NaHCO3溶液的pH___CH3COONa溶液的pH。
③NH4HCO3溶液显__性,原因是_________。
(2)能证明Na2SO3溶液中存在SO32-+H2OHSO3—+OH-水解平衡的事实是___。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(3)25 ℃时,浓度均为0.1 mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO2—)___c(CH3COO-)。若要使两溶液的pH相等应___。
a.向NaClO2溶液中加适量水 b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体 d.向CH3COONa溶液中加适量的水
(4)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。若测定结果偏高,其原因可能是_____。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
D.滴定管滴定前无气泡,滴定后有气泡
(2)判断滴定终点的现象是________。
(3)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(4)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
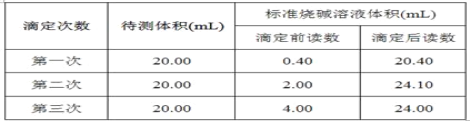
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反应原理如图所示。关于该反应过程的说法正确的是
溶液,反应原理如图所示。关于该反应过程的说法正确的是

A.该反应过程中,![]() 是
是![]() 是
是![]() B.当有
B.当有![]() 生成时,转移
生成时,转移![]() 电子
电子
C.在![]() 分解过程中,溶液的
分解过程中,溶液的![]() 逐渐降低D.
逐渐降低D.![]() 的氧化性比
的氧化性比![]() 强,还原性比
强,还原性比![]() 弱
弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某些强酸盐的水溶液呈中性,如NaCl溶液,某些弱酸盐的水溶液呈碱性,如Na2CO3溶液。请根据如下图所示转化关系回答有关问题。A和B均为焰色反应呈黄色的水溶液,A呈中性,B呈碱性并具有强氧化性。
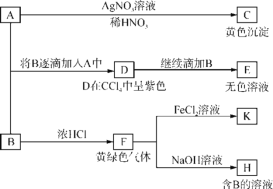
(1)写出C的化学式:________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: ___________________,_____________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:____________。
(4)检验K溶液中阳离子的简易方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锰(MnTiO3)纳米材料是一种多用途催化剂。工业上用红钛锰矿(主要成分有MnTiO3,还含有少量FeO、Fe2O3、SiO2等杂质)来制备MnTiO3,其工艺流程如图所示:
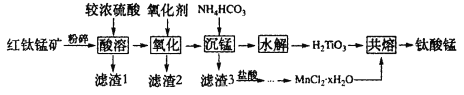
已知①红钛锰矿“酸溶”后Ti元素主要以TiO2+的形式存在;
②H2TiO3不溶于无机酸和碱,不溶于水;
③在空气中加热无水MnCl2分解放出HCl,生成Mn3O4。
回答下列问题:
(1)“粉碎”的目的是__。
(2)“酸溶”中发生的主要反应化学方程式为__。
(3)为了更好地把滤渣2分离出来,除搅拌外,还需要(填操作名称)___。
(4)“氧化”的氧化剂选用的是高锰酸钾,而不选择通常人们认可的绿色氧化剂“双氧水”,除了高锰酸钾氧化性强、反应快之外,还可能的原因是__(写出一条即可)。
(5)“沉锰”的条件一般控制在45℃以下的原因是__。
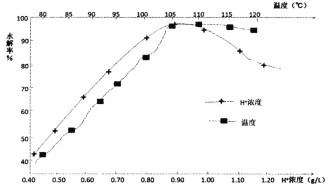
(6)TiO2+的水解率受温度和H+浓度的影响如图所示,TiO2+最适宜的水解条件是__。
(7)测定所得MnCl2·xH2O晶体中结晶水的含量。取29.70g样品加热分解,热重曲线(TG)如图所示。
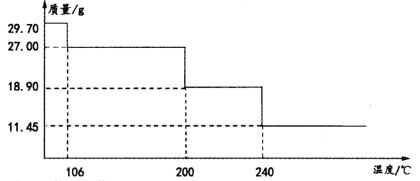
所得氯化锰晶体x的值是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应B.氢氧化铍难溶于水
C.氧化铍的化学式为![]() D.氯化铍溶液和铍酸钠溶液混合会有沉淀
D.氯化铍溶液和铍酸钠溶液混合会有沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com