
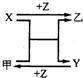
 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题: MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为
MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为 ,
, ;
; ;
; ,乙为NaCl,故答案为:
,乙为NaCl,故答案为: ;
;
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6,结构如图所示.下列关于维生素C的叙述错误的是( )
维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6,结构如图所示.下列关于维生素C的叙述错误的是( )| A、维生素C能使溴水褪色 |
| B、维生素C可作食品添加剂 |
| C、维生素C可发生水解反应 |
| D、维生素C不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液焰色反应呈黄色 |
| B、NH3能使湿润的红色石蕊试纸变蓝 |
| C、漂白粉的主要成分是次氯酸钙和氯化钙 |
| D、进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②③④ |
| C、全部 | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150 mL 1 mol?L-1氯化钠溶液 |
| B、75 mL 1.5 mol?L-1氯化钙溶液 |
| C、150 mL 3 mol?L-1氯化钾溶液 |
| D、50 mL 3 mol?L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com