
| A、在强碱存在的条件下,酯在水中的溶解度增大 |
| B、加催化剂,使氮气和氢气在一定条件下转化为氨气 |
| C、可用浓氨水和氢氧化钠固体快速制取氨气 |
| D、500℃左右比室温更有利于合成氨反应 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
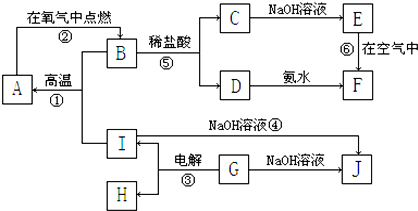
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2是氧化产物,且还原剂与氧化剂物质的量之比是8:3 |
| B、N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
| C、NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是8:3 |
| D、NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L四氯化碳含碳原子数为0.1NA | ||
B、标准状况下,a L的氧气和氮气的混合物含有的分子数为
| ||
| C、7g CnH2n中含有的氢原子数为2NA | ||
| D、2L1mol/L的盐酸中所含氯化氢分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、元素周期表中,同一主族元素的性质具有一定的相似性和递变性.NaOH是强碱,则CsOH碱性更强 |
| C、由于键能E(N≡N)>E(Cl-Cl),故单质的沸点:N2>Cl2 |
| D、SO2通入BaCl2溶液无明显现象,则SO2通入Ba(NO3)2溶液也无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蜡烛燃烧,葡萄酒化 |
| B、汽车爆胎、米饭煮糊 |
| C、水果腐烂、蔗糖溶解 |
| D、玻璃破碎、鲜肉冷冻 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、遇酚酞显无色的溶液 |
| C、含有H+的溶液 |
| D、溶液中由水电离出的C(OH-)=10-9 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com