
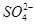 、
、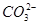 、
、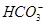 、
、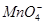 。
。 。
。| 实验操作 | 现象 |
| a.取少量粉末,加水、振荡 | 全部溶解、 |
| 溶液无色透明 | |
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
| c.取少量粉末,加盐酸 | 无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:不详 题型:单选题
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1molCu与足量硫反应生成Cu2S,转移的电子数为2 N A |
B.R2+的质量数为A,中子数为N,则ngR该价态的氧化物中含质子数为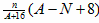 N A N A |
| C.氯化铁生成Fe(OH)3胶体的离子方程式:Fe3++3H2O =Fe(OH)3↓+3H+ |
| D.在加入铝片能生成氢气的溶液中一定共存的离子组:Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.使石蕊试液变红的溶液中:I-、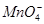 、 、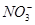 、Na+ 、Na+ |
B.含有大量Fe3+的溶液: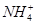 、 、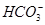 、 、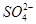 、 、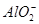 |
C.水电离出c(H+)=1.0×10-12mol/L的溶液:Cl-、Na+、ClO-、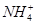 |
D.澄清透明的溶液:Cu2+、Fe3+、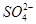 、 、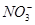 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
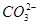 、
、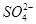 、
、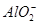 、
、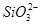 、
、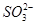
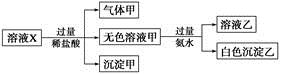
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
C.K+、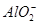 和 和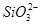 一定存在于溶液X中 一定存在于溶液X中 |
D.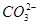 和 和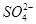 一定不存在于溶液X中 一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
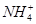 )由大到小的顺序为________;
)由大到小的顺序为________;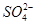 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(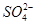 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
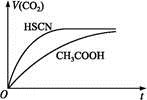
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
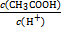
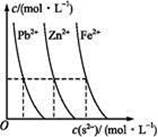
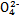 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。
Ag+(aq)+Cl-(aq)在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号),此时溶液②中Cl-物质的量浓度为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com