
| 4×10-14 |
| 4×10-13 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
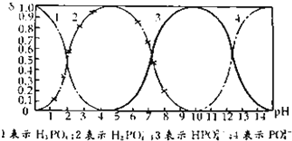 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 评价 |
| A | H+、Mg2+、Br-、NO3- | 能大量共存于同一溶液中,投入少量锌粉后,可放出H2 Zn+2H+=2Zn2++H2↑ |
| B | NH4+、CO32-、Cl-、Al3+ | 不能大量共存于同一溶液中,因为有沉淀生成 2Al3++3CO32-=Al2(CO3)3↓ |
| C | C6H5O-、Na+、K+、HSO3- | 能大量共存于同一溶液中 |
| D | HCO3-、OH-、Na+、K+ | 不能大量共存于同一溶液中,因为发生如下反应 HCO3-+OH-=CO32-+H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)=1×10-11mol?L-1 |
| B、pH=3的CH3COOH溶液 |
| C、pH=4的H2SO4溶液 |
| D、c(H+)=1×10-3mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com