
分析 溶液酸碱性取决于溶液中氢离子浓度和氢氧根离子浓度大小,盐类水溶液中,弱离子结合水电离出的氢离子或氢氧根离子形成弱电解质,促进水的电离平衡正向进行,导致溶液中氢离子浓度和氢氧根离子浓度大小不同,使溶液显示了酸碱性.
解答 解:一种溶液是显酸性、中性还是碱性,取决于溶液中 氢离子浓度和氢氧根离子浓度大小.有弱才水解,谁强显谁性,通常强酸弱碱盐的溶液呈酸性,氯化铵是强酸弱碱盐,氯化铵电离产生的 铵根离子可以与水电离产生的氢氧根离子结合成弱电解质一水合氨,消耗溶液中的氢氧根离子,使水的电离平衡向电离方向移动,最终导致溶液中氢离子浓度大于 氢氧根离子浓度,因而NH4Cl溶液显 酸性.这一反应可以表示为NH4++H2O?NH3•H2O+H+,
故答案为:氢离子浓度和氢氧根离子浓度大小;酸;铵根离子;氢氧根离子;弱电解质一水合氨;氢氧根离子;电离方向;氢离子浓度;氢氧根离子浓度;酸;NH4++H2O?NH3•H2O+H+.
点评 本题考查了盐类水解原理、水解实质和过程的分析判断、溶液酸碱性的判断,掌握基础是解题关键,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
 .
.| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
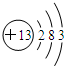
 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):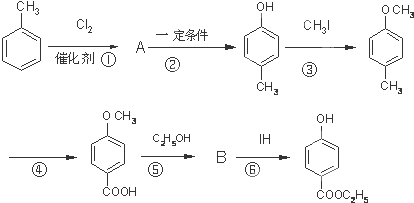
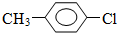 .
. +CH3I→
+CH3I→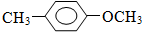 +HI
+HI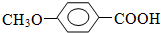 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$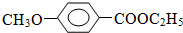 C2H5OH+H2O
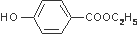
C2H5OH+H2O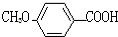 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式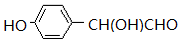 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
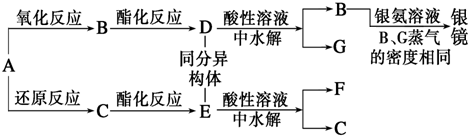
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 有机食品是指含有机物的食品 | ||
| C. | OTC表示处方药 | D. | 加碘盐是在食盐中加入KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com