
 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3分析 (1)确定砷在元素周期表中的位置,然后根据构造原理写出电子排布式;
(2)a、根据元素周期律,S、P、Cl三种元素位于同一周期,但P最外层处于半充满状态,故按S、P、Cl的顺序第一电离能依次增大;
b、NH3分子间可以形成氢键,增大了熔沸点,AsH3的范德华力大于PH3,因此熔沸点从高到低的顺序为NH3、AsH3、PH3;
c、PO43-、SO42-、ClO4-原子数相同,电子总数也相同,互为等电子体,中心原子的价层电子对数都是4,都不含孤电子对数,空间构性都是四面体形;
d、化合物 中N形成了N=C、和N-C,N原子的杂化方式为sp2;
中N形成了N=C、和N-C,N原子的杂化方式为sp2;
(3)CoCl3•5NH3和硝酸银溶液作用时,其中两个氯离子迅速沉淀,第三个氯离子沉淀缓慢,说明有1个Cl做配体,含1mol CoCl3•5NH3的溶液中含有3mol离子,说明阴离子为2个氯离子,NH3作配体,配离子带两个正电荷;
(4)根据磷化硼的结构简式可知,以顶点上磷原子为例,与该磷原子原子周围距离最近的磷原子位于经过这个点的面的面心上原子,B原子最外层有三个电子,而磷原子最外层有五个电子,据此分析;
(5)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol.
解答 解:(1)砷位于元素周期表的第四周期第VA族,外围电子排布为4s24p3,
故答案为:4s24p3;
(2)a、根据元素周期律,S、P、Cl三种元素位于同一周期,但P最外层处于半充满状态,故按S、P、Cl的顺序第一电离能依次增大,故a正确;
b、NH3分子间可以形成氢键,增大了熔沸点,AsH3的范德华力大于PH3,因此熔沸点从高到低的顺序为NH3、AsH3、PH3,故b错误;
c、PO43-、SO42-、ClO4-原子数相同,电子总数也相同,互为等电子体,中心原子的价层电子对数都是4,都不含孤电子对数,空间构性都是四面体形,
故c正确;
d、化合物 中N形成了N=C、和N-C,N原子的杂化方式为sp2,故d错误;
中N形成了N=C、和N-C,N原子的杂化方式为sp2,故d错误;
故答案为:bd;
(3)CoCl3•5NH3和硝酸银溶液作用时,其中两个氯离子迅速沉淀,第三个氯离子沉淀缓慢,说明有1个Cl做配体,含1mol CoCl3•5NH3的溶液中含有3mol离子,说明阴离子为2个氯离子,NH3作配体,配离子带两个正电荷,所以配离子的化学式为[CoCl(NH3)5]2+,
故答案为:[CoCl(NH3)5]2+;
(4)根据磷化硼的结构简式可知,以顶点上磷原子为例,与该磷原子原子周围距离最近的磷原子位于经过这个点的面的面心上原子,共有12个,B原子最外层有三个电子,而磷原子最外层有五个电子,所以形成磷化硼晶体时有配位键和共价键,故选bd,
故答案为:12;bd;
(5)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,
故答案为:3.
点评 本题考查较综合,涉及核外电子排布、电离能、氢键、空间构型及化学键的判断、计算等知识点,分子空间构型是考试热点,要注重基础知识的积累,题目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
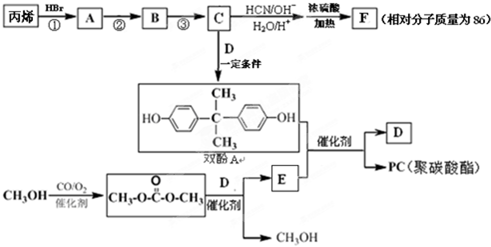

 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 菠萝酯不存在顺反异构现象 | B. | 原料中最多5个原子共线 | ||
| C. | 菠萝酯中所有的原子都可能共平面 | D. | 中间体和菠萝酯中均含手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
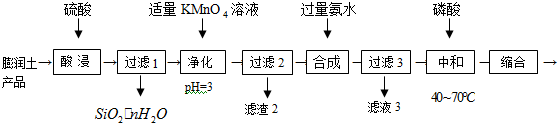
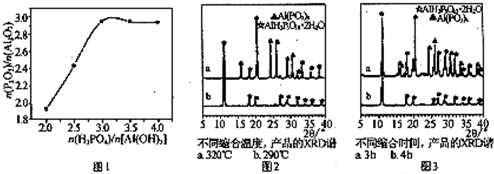
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
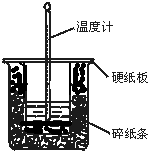 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com