
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是( )
A. 灼烧海带:
B. 将海带灰溶解后分离出不溶性杂质: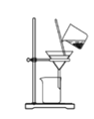
C. 制备Cl2,并将I-氧化为I2:
D. 以淀粉为指示剂,用Na2S2O3标准溶液滴定: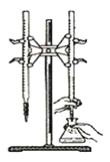
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中投入1molC和1molBaSO4,一定温度下发生反应:3C(s)+BaSO4(s)![]() BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
BaS(s)+2CO(g)+CO2(g)(注明:s代表固体,g代表气体)。下列情况下表明该反应达到最大限度(平衡状态)的是( )
A.混合气体平均摩尔质量不再变化
B.CO的体积分数不再变化
C.硫酸钡浓度不再变化
D.混合气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
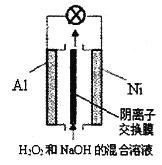
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
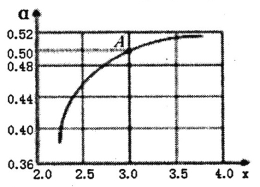
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
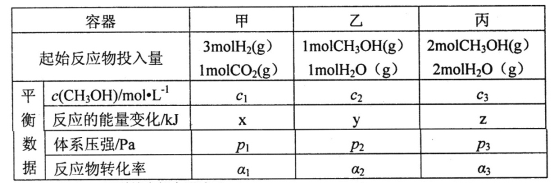
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2是一种强碱,可用于测定天然气中CO2的含量。
(1)请写出足量氢氧化钡溶液吸收CO2气体的离子方程式:__________。
(2)某课外小组通过以下实验操作测定Ba(OH)2·nH2O中n的值。
①称取5.25g试样(含有杂质)配成100mL溶液。配置溶液中用到的仪器有天平、__________、__________、__________和胶头滴管。若配制过程中定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水,则所得溶液的浓度将__________(填“偏大”、“不变”或“偏小”)。
②用30.00mL 1mol·L-1盐酸与上述Ba(OH)2溶液反应,消耗该Ba(OH)2溶液100.00mL(杂质不与酸反应),则该Ba(OH)2溶液的物质的量浓度为__________。
③另取5.25g试样加热至失去全部结晶水(杂质不分解),称得剩余固体质量为3.09g,则Ba(OH)2·nH2O中n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。提示:图中A代表沉淀或者溶液

(1)检验提纯后的KCl中是否还含有SO42-的方法是____________________________。
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为__________。
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的______。(填数字符号)
③下列操作会使所配溶液浓度偏低的是__________(填选项代号)。
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为______,试剂Ⅱ的化学式为______,试剂Ⅲ的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中含有多种污染物,其中有氮氧化物(NOx)、CO、SO2等,给人类健康带来了严重影响,化学在解决雾霾污染中发挥了重要作用。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原消除污染。请写出CH4与NO2反应的化学方程式_____________。
(2)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ·mol-1
N2(g)+2CO2(g) △H=-746.8kJ·mol-1
4CO(g)+2NO2(g)![]() 3CO2(g)+N2(g) △H=-1200kJ·mol-1
3CO2(g)+N2(g) △H=-1200kJ·mol-1
则反应的CO(g)+NO2(g)![]() CO2(g)+NO(g) △H=_____kJ·mol-1
CO2(g)+NO(g) △H=_____kJ·mol-1
(3)氮硫的氧化物间存在如下转化SO2(g)+NO2(g)![]() SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:
SO3(g)+NO(g);实验测得平衡常数 与温度的关系如下图所示。回答下列问题:

①该反应正反应的活化能___(填“>”或“<”)逆反应的活化能。
②反应速率v=V正-V逆=k正xSO2·xNO2-k逆xSO3·xNO,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,T℃时,k正_____k逆(填“>”、“<”或“=”)。
③T℃时,在体积为2L的容器中加入1molSO2(g)、1molNO2(g),5min时测得xSO3=0.2,此时平衡向___(填“正”或“逆”)反应方向移动,![]() =___(保留2位小数)。
=___(保留2位小数)。
(4)已知:2NO(g)=N2(g)+O2(g) ΔH=-180.6kJ/mol,在某表面催化剂的作用下,NO可以分解生成N2、O2,其反应机理可简化为:
第一步:2NO →N2O2 快
第二步:N2O2 →N2+O2 慢
下列表述正确的是____(填标号)。
A.所有化合反应都是放热反应
B.N2O2是该反应的的中间产物
C.加入合适的催化剂可以减小反应热ΔH,加快反应速率
D.第一步的活化能比第二步低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
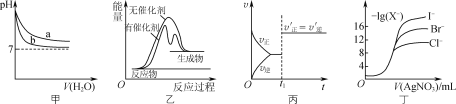
A. 图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线a对应氨水
B. 图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 图丙表示CO(g)+Cl2(g)![]() COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
D. 图丁表示用0.0100mol·L-1的硝酸银标准溶液滴定浓度均为0.1000mol·L-1 Cl-、Br-及I-的混合溶液时,先沉淀的是Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com