
| A. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移电子数为NA |
分析 A.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合原子构成判断,1个D2O分子中含电子数为10个;
B.根据n=$\frac{m}{M}$,结合1个氮气分子的含电子数为14计算分析;
C.根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算;
D.根据氧化还原反应在守恒分析,反应中电子转移依据氢气的物质的量计算.
解答 解:A.n=$\frac{18g}{20g/mol}$=0.9mol,所含的电子数为9NA,故A错误;
B.14g氮气含有的核外电子数=$\frac{14g}{28g/mol}$×2×7×NA=7NA,故B错误;
C.标准状况下,22.4L任意比的氢气和氯气的混合气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,分子数为NA,故C正确;
D.铝与氢氧化钠溶液反应中氢元素化合价由+1价降低为0价,反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数应用,物质的量和微粒数的计算,题目难度不大,本题注意把握物质的状态、结构等特点,也是为易错点.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
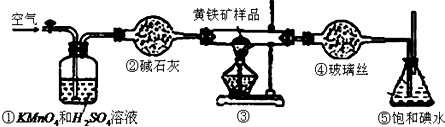
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+和H2是氢元素的五种不同粒子 | |
| B. | 石墨和金刚石互为同位素,化学性质相似 | |
| C. | ${\;}_{1}^{1}$H和 ${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和 14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是良好的半导体材料 | B. | 硅胶常用作食品干燥剂 | ||
| C. | 二氧化硅坚硬但易溶于水 | D. | 玻璃、水泥、陶瓷都属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
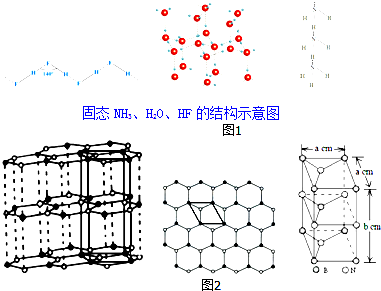
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com