
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.
请回答下列问题:
(1)该“84消毒液”的物质的量浓度为molL﹣1 .
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)“84消毒液”可用氯气和氢氧化钠溶液反应制得,写出该反应的化学方程式: .
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液.
需要称量NaClO固体的质量为g.
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是(填选项字母).
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
【答案】
(1)6
(2)0.06
(3)Cl2+2NaOH═NaCl+NaClO+H2O
(4)223.5
(5)A,D
【解析】解:(1)c(NaClO)= ![]() =
= ![]() =6molL﹣1,所以答案是:6;(2)稀释后c(NaClO)=
=6molL﹣1,所以答案是:6;(2)稀释后c(NaClO)= ![]() ×6molL﹣1=0.06molL﹣1,c(Na+)=c(NaClO)=0.06molL﹣1,所以答案是:0.06;(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH═NaCl+NaClO+H2O;(4)欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液即选用500ml容量瓶,又由(1)该溶液浓度为6molL﹣1,所以需要称量NaClO固体的质量为6×0.5×74.5=223.5g,所以答案是:223.5g;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,浓度偏小;
×6molL﹣1=0.06molL﹣1,c(Na+)=c(NaClO)=0.06molL﹣1,所以答案是:0.06;(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,所以答案是:Cl2+2NaOH═NaCl+NaClO+H2O;(4)欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液即选用500ml容量瓶,又由(1)该溶液浓度为6molL﹣1,所以需要称量NaClO固体的质量为6×0.5×74.5=223.5g,所以答案是:223.5g;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,浓度偏小;
B.容量瓶在使用前未干燥,里面有少量蒸馏水,无影响;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净,导致n偏大,则浓度偏大;
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线溶液体积偏大,浓度偏小;
故选:AD.


科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于吸热反应的是
A. 锌片与稀硫酸的反应
B. 灼热的炭与水蒸气的反应
C. 乙醇在空气中的燃烧反应
D. Ba(OH)2 ·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产玻璃会产生大量的窑炉气(含SO2和氮氧化物等).为减少环境污染,某工厂生产玻璃与处理窑炉气的工艺流程如下: 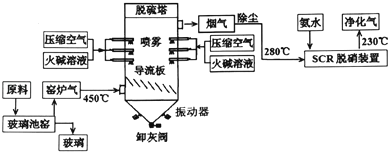
(1)生产普通硅酸盐玻璃的主要原料是石英砂、 和石灰石。其中,石灰石参与的反应方程式是 。
(2)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,该反应方程式为 ;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,原因是 。
(3)“脱硫塔”中反应形成的灰分,除亚硫酸钠和氮的含氧酸盐外,主要还有 ;用于喷雾的火碱溶液应选用软化水配制,原因是 。
(4)在“脱硝装置”中,催化剂设计成蜂窝而韭平板状结构.原因是 。氧气在脱硝过程中的作用是
(5)净化气的主要成分是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烷烃,它们的分子式都是C8H18。
(1)A不能由任何分子式为C8H16的异构体加H2得到,A的结构简式为。
(2)B可以而且只能由一种分子式为C8H16的物质加H2得到,B的结构简式为。
(3)C可以而且只能由两种分子式为C8H16的物质D或E加H2得到,C的结构简式为 , D和E的结构简式分别为和。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO33H2O2 )是由Na2CO3﹣与H2O2复合而形成的一种固体放氧剂,可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%= ![]() ×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1:
×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1: 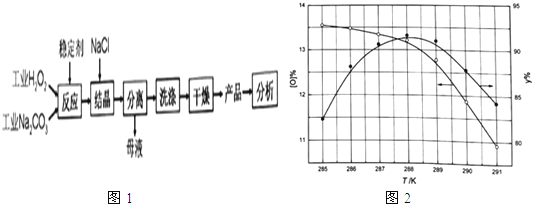
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式 .
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是(填字母).a.MnO2b.KI c.Na2SiO3d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如图1所示.要使产品达到优等品且产率超过90%合适的反应温度范围是 .
③“结晶”时加入NaCl的目的是 , 其作用原理是 .
(3)“母液”中可循环利用的主要物质是 .
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5molL﹣1硫酸溶解完全,立即用0.02000molL﹣1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mLo另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有 .
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响及其原因 .
③该样品的活性氧含量为%,表明该样品(填“是”或“不是”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .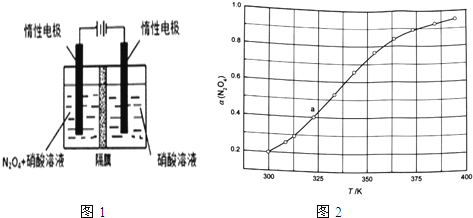
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .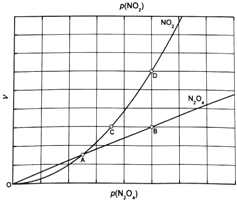
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列药物知识,不正确的是 ( )
A.OTC是非处方药的标志,可以自行购药和按方使用
B.肠溶片不可嚼碎服用,因为肠溶衣在碱性肠液下溶解才能发挥药效
C.抗生素能抵抗所有细菌感染,可以大量使用
D.凡不以医疗为目的的滥用麻醉药品与精神药品都属于吸毒范围
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com