
����Ŀ����̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ����������������ϴ�ӡ���֯��ҽҩ������������ҵ�ϳ��Թ�̼���Ʋ�Ʒ�л�����������[O]%= ![]() ��100�������������ӣ�13%����Ϊ�ŵ�Ʒ��һ���Ʊ���̼���ƵĹ���������ͼ1��
��100�������������ӣ�13%����Ϊ�ŵ�Ʒ��һ���Ʊ���̼���ƵĹ���������ͼ1�� 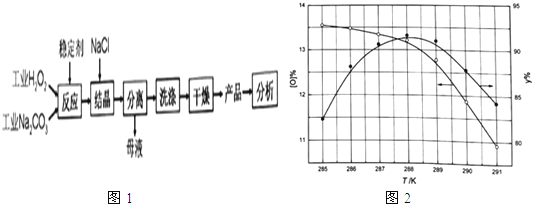
�ش��������⣺
��1����̼���������ֽ⣬д����Ӧ�Ļ�ѧ����ʽ ��
��2���ȶ�������Ӧ�¶ȵ����ضԲ�Ʒ�����кܴ�Ӱ�죮
�������Լ��У������������ȶ���������������ĸ����a��MnO2b��KI c��Na2SiO3d��FeCl3
�ڷ�Ӧ�¶ȶԲ�Ʒ���ʣ�y%����������������Ӱ����ͼ1��ʾ��Ҫʹ��Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%���ʵķ�Ӧ�¶ȷ�Χ�� ��
�ۡ��ᾧ��ʱ����NaCl��Ŀ���� �� ������ԭ���� ��
��3����ĸҺ���п�ѭ�����õ���Ҫ������ ��
��4����Ʒ�л����������IJⶨ����������0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�������Һ��dz��ɫ�Ұ�����ڲ���ɫ��Ϊ�յ㣬ƽ�����Σ�����KMnO4��Һ��ƽ�����Ϊ26.56mLo���⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬����KMn04��Һ��ƽ�����Ϊ2.24mL��
�ٹ�̼���������ᷴӦ������������ƺ�ˮ�⣬���� ��
�ڲⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ�����Ӱ�켰��ԭ�� ��
�۸���Ʒ�Ļ���������Ϊ%����������Ʒ����ǡ����ǡ���
���𰸡�
��1��2��Na2CO3?3H2O2 �� ![]() 4Na2CO3+3O2��+6H2O
4Na2CO3+3O2��+6H2O
��2��c��286.8��288.5K����߲���������������Ũ�ȣ��ٽ���̼��������
��3��NaCl
��4��H2O2��CO2��ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻12.16������
����������1����̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ�������������ȷֽ�����̼���ơ�������ˮ����ӦΪ��2��Na2CO33H2O2 �� ![]() 4Na2CO3+3O2��+6H2O�����Դ��ǣ�2��Na2CO33H2O2 ��
4Na2CO3+3O2��+6H2O�����Դ��ǣ�2��Na2CO33H2O2 �� ![]() 4Na2CO3+3O2��+6H2O����2���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ��������������̼���ƺ�����������ʣ����������ֽ⣬MnO2��FeCl3Ϊ����������Բ���ѡ����������������ӷ���������ԭ��Ӧ��2I��+H2O2+2H+=I2+2H2O������Ҳ����ѡ����̼����������Ʋ���Ӧ�������������ȶ���������Cѡ����ϣ����Դ��ǣ�c���ڸ���ͼ��������¶�Ϊ286.8��288.5K����Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%������288.5K�������ٷֺ����Ͳ��ʾ����ͣ�������ѷ�Ӧ�¶ȷ�ΧΪ286.8��288.5K�����Դ��ǣ�286.8��288.5K���۽ᾧ�����м����Ȼ��ơ����裬����������Ũ�ȣ��ܽ���̼���Ƶ��ܽ�ȣ������ڹ�̼�������������Դ��ǣ���߲���������������Ũ�ȣ��ٽ���̼������������3���ᾧ�����м����Ȼ��ƴٽ���̼������������ĸҺ������ҪΪ�Ȼ�����Һ��NaCl��Һ���ǽᾧ�����дٽ���̼����������ԭ�ϣ���ѭ�����õ�������NaCl�����Դ��ǣ�NaCl����4���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ������������̼���������ᷴӦ��Ϊ̼���ơ�������������ᷴӦ�����Բ���Ϊ�����ơ��������⡢������̼��ˮ�����Դ��ǣ�H2O2��CO2����Fe3+Ϊ��������ֽ�Ĵ�������ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣬�ⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ���ƫ�ͣ����Դ��ǣ�ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻�۳���0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�����Ӧ��MnO4������������H2O2�ǻ�ԭ��������������O2������Ԫ�ػ��ϼ۱仯����Ԫ�ػ��ϼ۴�+7�۱仯Ϊ+2�ۣ����������е���Ԫ�ػ��ϼ۴ө�1�۱仯Ϊ0�ۣ����ݵ����غ���ƽд�����ӷ���ʽΪ��2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2���εζ�ƽ������KMnO4��Һ26.56mL�����ݷ�Ӧ2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2��
4Na2CO3+3O2��+6H2O����2���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ��������������̼���ƺ�����������ʣ����������ֽ⣬MnO2��FeCl3Ϊ����������Բ���ѡ����������������ӷ���������ԭ��Ӧ��2I��+H2O2+2H+=I2+2H2O������Ҳ����ѡ����̼����������Ʋ���Ӧ�������������ȶ���������Cѡ����ϣ����Դ��ǣ�c���ڸ���ͼ��������¶�Ϊ286.8��288.5K����Ʒ�ﵽ�ŵ�Ʒ�Ҳ��ʳ���90%������288.5K�������ٷֺ����Ͳ��ʾ����ͣ�������ѷ�Ӧ�¶ȷ�ΧΪ286.8��288.5K�����Դ��ǣ�286.8��288.5K���۽ᾧ�����м����Ȼ��ơ����裬����������Ũ�ȣ��ܽ���̼���Ƶ��ܽ�ȣ������ڹ�̼�������������Դ��ǣ���߲���������������Ũ�ȣ��ٽ���̼������������3���ᾧ�����м����Ȼ��ƴٽ���̼������������ĸҺ������ҪΪ�Ȼ�����Һ��NaCl��Һ���ǽᾧ�����дٽ���̼����������ԭ�ϣ���ѭ�����õ�������NaCl�����Դ��ǣ�NaCl����4���ٹ�̼���ƣ�2Na2CO33H2O2 ������Na2CO3����H2O2���϶��γɵ�һ�ֹ������������̼���������ᷴӦ��Ϊ̼���ơ�������������ᷴӦ�����Բ���Ϊ�����ơ��������⡢������̼��ˮ�����Դ��ǣ�H2O2��CO2����Fe3+Ϊ��������ֽ�Ĵ�������ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣬�ⶨʱ�����ù�ҵ����������ᣬ�����Բⶨ���ƫ�ͣ����Դ��ǣ�ƫ�ͣ���ҵ���᳣����Fe3+ �� �ܽ���̻��H2O2�ֽ⣻�۳���0.1600g��Ʒ����250mL��ƿ����100mL 0.5molL��1�����ܽ���ȫ��������0.02000molL��1������ر���Һ�ζ�����Ӧ��MnO4������������H2O2�ǻ�ԭ��������������O2������Ԫ�ػ��ϼ۱仯����Ԫ�ػ��ϼ۴�+7�۱仯Ϊ+2�ۣ����������е���Ԫ�ػ��ϼ۴ө�1�۱仯Ϊ0�ۣ����ݵ����غ���ƽд�����ӷ���ʽΪ��2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2���εζ�ƽ������KMnO4��Һ26.56mL�����ݷ�Ӧ2MnO4��+5H2O2+6H+=2Mn2++8H2O+5O2��
2MnO4������������5H2O2��
2 5
��0.2526��0.0224��L��0.02mol/L 0.01216mol
��̼���Ʋ�Ʒ�л�����������[O]%= ![]() ��100%=
��100%= ![]() =12.16%��13%����Ϊ�ŵ�Ʒ���ò�Ʒ���ǣ����Դ��ǣ�12.16�����ǣ�
=12.16%��13%����Ϊ�ŵ�Ʒ���ò�Ʒ���ǣ����Դ��ǣ�12.16�����ǣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.2.0gH2O��D2O�Ļ����������������ΪNA
B.��״����1.4 g��ϩ�������õ��Ӷ���Ϊ0.25NA
C.3 mol����Fe��ȫת��ΪFe3O4 �� ʧȥ8 NA������
D.50ml 12 molL��1����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��ҽҩ��Ⱦ�ϡ����ϵ���ҵ�ж����Ź㷺��Ӧ�á�ʵ����ͨ����ͼ��ʾ�������ɼױ������Ʊ�����ȩ���Իش��������⣺
��1��Mn2O3�����ױ��ķ�Ӧ��Ҫ���Ͻ��裬����������ǣ�
��2���ױ���������õ��Ļ����ͨ���ᾧ�����˽��з��룬�ù������轫�������ȴ����Ŀ���ǣ�
��3��ʵ������У���ѭ��ʹ�õ������У�
��4��ʵ���з���ױ��ͱ���ȩ���õIJ������� �� ��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Be��OH��2�����Եģ���ǿ�ᷴӦʱ����Be2+ �� ��ǿ�Ӧʱ����BeO22�� �� �������ݵ����ʵ���Ũ�ȡ��������BeCl2��MgCl2��AlCl3��Һ������ʱ�������������ᣩ���ֽ�һ��Ũ�ȵ�NaOH��Һ�ֱ����������Һ����������NaOH��Һ�����x��mL�������ɳ��������ʵ���y��mol���Ĺ�ϵ��ͼ��ʾ������BeCl2��MgCl2��AlCl3������Һ��Ӧ��ͼ����ȷ���ǣ������� 
A.�ݢۢ�
B.�ڢۢ�
C.�ۢݢ�
D.�ۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ�����ϡ�������������ȷ����(����)
A. ����������� B. ������һ����������
C. ����ʱ������ͭ������Ӧ D. �ڳ����¶�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ���á�84����Һ��ͨ��ϡ��100�������֮�ȣ���ʹ�ã�
��ش��������⣺
��1���á�84����Һ�������ʵ���Ũ��ΪmolL��1 ��
��2��ijͬѧȡ100mL�á�84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c��Na+��=molL��1 ��
��3����84����Һ����������������������Һ��Ӧ�Ƶã�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4����ͬѧ���ĸá�84����Һ�����䷽������NaClO��������480mL��NaClO��������37.25%������Һ��
��Ҫ����NaClO���������Ϊg��
��5������Һ���ƹ����У����в���ʹ��ҺŨ��ƫС��������ѡ����ĸ����
A.����ʱ��������ƿ�̶���
B.����ƿ��ʹ��ǰδ�����������������ˮ
C.����ƿ��ʹ��ǰ�ո�������һ�����ʵ���Ũ�ȵġ�84����Һ����δϴ��
D.����ҡ�Ⱥ���Һ���������ƿ�Ŀ̶��ߣ����ý�ͷ�ιܼ�ˮ���̶��ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ػ�����ƽ�����ȼ��β����������������塣��������Ҫ�ɷ���CO2��H2O��N2��NO�ȣ��ڷ����ֳ��ɿ������β��������������ɫ���壬��ԭ����(����)
A. ������N2����������NO2
B. NO����������NO2
C. CO2��NO��Ӧ����CO��NO2
D. NO��H2O��Ӧ����H2��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ�������ԭ�ϡ�����ϩ�ϳɹ�ѧ��֬CR39����Ĺ������£�
��֪��
��.CR39����ṹ��ʽ��
��.���봼�����·�Ӧ��
RCOOR�䣫R��OH ![]() RCOOR�士R��OH(R��R�䡢R���������)
RCOOR�士R��OH(R��R�䡢R���������)
��1����ϩת��ΪA�ķ�Ӧ������ �� B�й�������������
��2����D��E�ķ����У���ֻ��һ�ֻ�ѧ��������ԭ�ӡ�
��D�Ľṹ��ʽ����
��EΪ��Ԫ��״�����E��CH3OH��Ӧ�Ļ�ѧ����ʽ��
��
��3��G������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ����
��4��F��һ��ͬ���칹��K��������в�ͬ��ѧ��������ԭ�Ӹ�������3��1��1��1��������NaHCO3��Ӧ��
��K�ܷ�����ȥ��Ӧ�����ɵ��л���Ľṹ��ʽ����
��K��һ�������ºϳɸ߷��ӻ�����Ļ�ѧ����ʽ��
��
��5�������й�C��������ȷ���ǣ� ��(��д���)��
A.�������ᷢ��������Ӧ
B.�����Ҵ�����������Ӧ
C.1molC�������2molNa��Ӧ
D.C��ͬ���칹�岻�ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������Ԫ���⣬������Ԫ�ص�����ϼ�����ֵ�϶����ڸ�Ԫ��������������
B.��������С�ĵ����������
C.ͬ��s�ܼ����ڲ�ͬ�ĵ��Ӳ����������ɵ����������Dz���ͬ��
D.��������Ų���ȫ��ͬ�����������仯ѧ����һ����ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com