
【题目】NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.2.0gH2O与D2O的混合物中所含中子数为NA
B.标准状况下1.4 g乙烯所含共用电子对数为0.25NA
C.3 mol单质Fe完全转变为Fe3O4 , 失去8 NA个电子
D.50ml 12 molL﹣1盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】C
【解析】A、重水的摩尔质量为20g/mol,水的摩尔质量为18g/mol,由于2.0g混合物中H2O与D2O的质量分别是多少不明确,故混合物的物质的量不明确,则含有的中子数无法计算,故A错误;
B、1.4g乙烯的物质的量为0.05mol,而乙烯中含6对共用电子对,故0.05mol乙烯中含0.3mol共用电子对即0.3NA个,故B错误;
C、铁转变为Fe3O4时变为+ ![]() 价,故3mol铁失去8mol电子即8NA个,故C正确;
价,故3mol铁失去8mol电子即8NA个,故C正确;
D、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故50ml 12 molL﹣1盐酸即0.6mol盐酸不能反应完全,则生成的氯气的物质的量小于0.15mol即0.15NA个氯气分子,故D错误.
故选C.


科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( ) 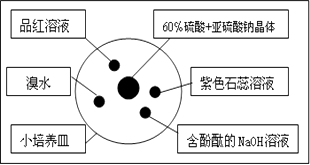
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题: 
(1)常温下含氢量最高的气态烃是(填字母).
(2)G的名称是
(3)能够发生加成的烃有种.
(4)一卤代物种类最多的是(填字母).
(5)写出实验室制D的化学方程式: .
(6)写出F发生硝化反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于萃取操作的说法正确的是( )
A. 从碘水中萃取碘,可用酒精作萃取剂
B. 萃取操作完成后,静置分层,上下层液体依次从下口放出
C. 用一种有机溶剂,提取水溶液中的某物质,静置分层,“水层”应在上层
D. 萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于吸热反应的是
A. 锌片与稀硫酸的反应
B. 灼热的炭与水蒸气的反应
C. 乙醇在空气中的燃烧反应
D. Ba(OH)2 ·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL﹣1NaOH溶液中加入0.1molL﹣1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
A.a点所示溶液中c(HA)>c(A﹣)
B.a点所示溶液中c(Na+)=c(A﹣)+c(HA)
C.当加入HA溶液10mL时,c(OH﹣)<1.0×10﹣7molL﹣1
D.b点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火力发电厂使用的燃料煤中硫的质量分数为0.32%.该电厂每天要燃烧这种煤200t,请通过计算回答:
(1)如果煤中的硫全部转化为SO2 , 该电厂每天燃烧产生SO2多少升(标准状况)?
(2)将SO2用“钙基固硫法”处理可以“变废为宝”:SO2 ![]() CaSO3
CaSO3 ![]() CaSO4假设转化过程的损失可以忽略不计,计算该电厂每天用“钙基固硫法”处理产生的SO2 , 可获得纯度为85%的CaSO4多少吨?
CaSO4假设转化过程的损失可以忽略不计,计算该电厂每天用“钙基固硫法”处理产生的SO2 , 可获得纯度为85%的CaSO4多少吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO33H2O2 )是由Na2CO3﹣与H2O2复合而形成的一种固体放氧剂,可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%= ![]() ×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1:
×100)来衡量其优劣,13%以上为优等品.一种制备过碳酸钠的工艺流程如图1: 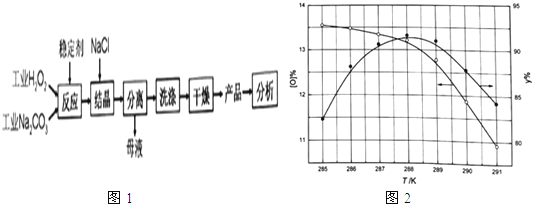
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式 .
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是(填字母).a.MnO2b.KI c.Na2SiO3d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如图1所示.要使产品达到优等品且产率超过90%合适的反应温度范围是 .
③“结晶”时加入NaCl的目的是 , 其作用原理是 .
(3)“母液”中可循环利用的主要物质是 .
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5molL﹣1硫酸溶解完全,立即用0.02000molL﹣1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mLo另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有 .
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响及其原因 .
③该样品的活性氧含量为%,表明该样品(填“是”或“不是”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com