
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:6I-+8H++2NO3-=3I2+4H2O+2NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| D. | 只含有共价键的物质一定是共价化合物 |
分析 A.碘离子、二价铁离子都具有还原性,氢离子少量,碘离子先被氧化;
B.氯化铵为离子化合物;
C.少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
D.只含有共价键的物质可能共价化合物,也可能是非金属单质如H2.
解答 解:A.在酸性溶液中NO3-具有氧化性,由于I-的还原性强于Fe2+的,所以首先氧化的是I-,离子方程式:6I-+8H++2NO3-=3I2+4H2O+2NO↑,故A正确;
B.非金属元素形成的化合物不一定是共价化合物,例如氯化铵,为离子化合物,故B错误;
C.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故C错误;
D.只含有共价键的物质可能共价化合物,也可能是非金属单质如H2,故D错误;
故选:A.
点评 本题考查了离子方程式、化学方程式的书写正误判断,明确反应实质是解题关键,注意反应物用量对反应的影响,注意离子还原性强弱顺序,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
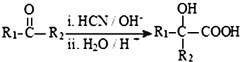 (R、R1、R2、R3均代表烃基)
(R、R1、R2、R3均代表烃基)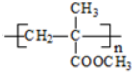 .
.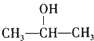 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2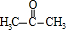 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 试剂如下: | 溶 液 温 度 | 中和热△H | ||||
| t1 | t2 | |||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | ||
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | ||
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
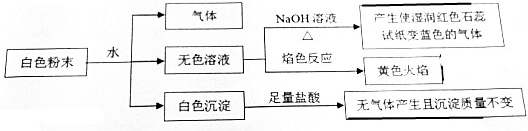
| A. | 一定含有BaCl2、Mg(NO3)2、NaHCO3、X,且X是NH4HSO4 | |
| B. | 一定不含K2CO3、CuSO4,X是NH4Al(SO4)2 | |
| C. | 一定含有BaCl2、NaHCO3、X且X是NH4AlO2,另一种为NaCl和Mg(NO3)2中的任一种 | |
| D. | 一定含有NaCl、BaCl2、NaHCO3和X,当X不能确定是什么物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
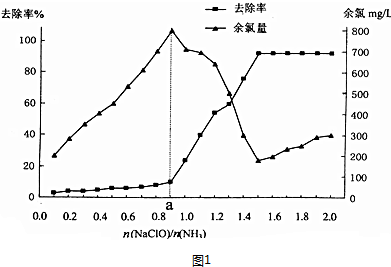
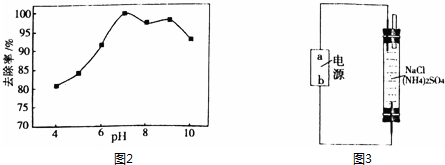
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯苯环上的一个氢原子被含 4 个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到10种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 银锌纽扣电池工作时,Ag2O被还原为Ag | |
| B. | 碱性锌锰电池中,MnO2是催化剂 | |
| C. | 放电时,铅酸蓄电池中硫酸浓度不断增大 | |
| D. | 电镀时,待镀的金属制品表面发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com