
分析 (1)反应①:NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(I)△H1=akJ•mol-1
反应②:NH2Cl(aq)+HClO(aq)═NHCl2(aq)+H2O(I)△H2=bkJ•mol-1
反应③:2NHCl2(aq)+H2O(I)═N2(g)+HClO(aq)+3HCl(aq)△H3=ckJ•mol-1
依据化学方程式和盖斯定律计算,①×2+②×2+③得到所热化学方程式;
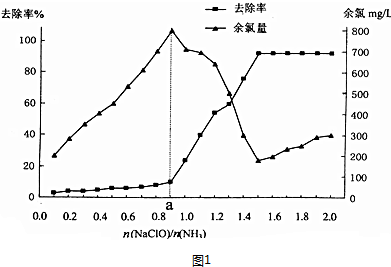
(2)用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,改变$\frac{n(NaClO)}{n(N{H}_{3})}$(即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(I);反应中氨氮去除效果最佳的从图象分析可知为去除率较高同时余氯量最少;
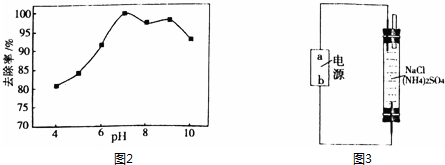
(3)在pH较低时溶液中,生成的次氯酸分解有无色无味的气体生成为氧气,次氯酸较少氨氮去除效率较低;
(4)在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高,是因为阳极上氯离子失电子发生氧化反应,阴极上氢离子得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大,结合铵根离子生成一水合氨,氯气上升过程中吸收,所以装置图可知b为正极,a为负极;
(5)3CaSO4(s)+2PO43-(aq)?Ca3(PO4)2(s)+3SO42-(aq),该反应的平衡常数K=$\frac{{c}^{3}(S{{O}_{4}}^{2-})}{{c}^{2}(P{{O}_{4}}^{3-})}$=$\frac{{c}^{3}(S{{O}_{4}}^{2-})}{{c}^{2}(P{{O}_{4}}^{3-})}$×$\frac{{c}^{3}(C{a}^{2+})}{{c}^{3}(C{a}^{2+})}$=$\frac{Ks{p}^{3}(CaS{O}_{4})}{Ksp(C{a}_{3}(P{O}_{4})_{2})}$计算.
解答 解:(1)反应①:NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(I)△H1=akJ•mol-1
反应②:NH2Cl(aq)+HClO(aq)═NH2Cl(aq)+H2O(I)△H2=bkJ•mol-1
反应③:2NHCl2(aq)+H2O(I)═N2(g)+HClO(aq)+3HCl(aq)△H3=ckJ•mol-1
依据化学方程式和盖斯定律计算,①×2+②×2+③得到所热化学方程式2NH3(aq)+HClO(aq)═N2(g)+3H2O(I)+3HCl(aq)△H=(2a+2b+c)KJ/mol,
故答案为:(2a+2b+c)KJ/mol;
(2)用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,改变$\frac{n(NaClO)}{n(N{H}_{3})}$(即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(I);反应中氨氮去除效果最佳的从图象分析可知为去除率较高同时余氯量最少,图象中符合的比值为1.5,
故答案为:A;1.5;
(3)在pH较低时溶液中,盐酸与次氯酸钠反应生成的次氯酸分解有无色无味的气体生成为氧气,次氯酸较少氨氮去除效率较低,
故答案为:盐酸与次氯酸钠反应生成的次氯酸,次氯酸分解产生氧气,与氨氮反应的次氯酸量减少了;
(4)在蒸馏水中加入硫酸铵用惰性电极直接电解发现氨氮去除效率极低,但在溶液中再加入一定量的氯化钠后,去除效率可以大大提高,是因为阳极上氯离子失电子发生氧化反应,阴极上氢离子得到电子发生还原反应生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大,结合铵根离子生成一水合氨,电极反应为:2H2O+2NH4++2e-=2NH3•H2O+H2↑或2H++2e-=H2↑,氯气上升过程中吸收,所以装置图可知b为正极,a为负极,
故答案为:正;2H2O+2NH4++2e-=2NH3•H2O+H2↑或2H++2e-=H2↑;
(5)3CaSO4(s)+2PO43-(aq)?Ca3(PO4)2(s)+3SO42-(aq),该反应的平衡常数K=$\frac{{c}^{3}(S{{O}_{4}}^{2-})}{{c}^{2}(P{{O}_{4}}^{3-})}$=$\frac{{c}^{3}(S{{O}_{4}}^{2-})}{{c}^{2}(P{{O}_{4}}^{3-})}$×$\frac{{c}^{3}(C{a}^{2+})}{{c}^{3}(C{a}^{2+})}$=$\frac{Ks{p}^{3}(CaS{O}_{4})}{Ksp(C{a}_{3}(P{O}_{4})_{2})}$=$\frac{(9.1×1{0}^{-6})^{3}}{2.0×1{0}^{-29}}$=3.77×1013,
故答案为:3.77×1013.
点评 本题考查了热化学方程式书写、图象曲线变化特征、电解池原理和电极反应书写、沉淀溶解平衡常数的计算等知识点,掌握基础是解题关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:6I-+8H++2NO3-=3I2+4H2O+2NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝作该电源的负极,电极反应为:Al-3e-═Al3+ | |
| B. | 电池总反应:2Al+3H2O2+6H+═2Al3++6H2O | |
| C. | 放电时溶液中的SO42-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应 2H2O+O2+4e-═4OH- | |
| B. | 表示H2燃烧热的热化学方程式 2H2(g)+O2 (g)═2H2O(g);△H=-483.6kJ/mol | |
| C. | 纯碱水解的离子方程式 CO32-+H2O?HCO3-+OH- | |
| D. | Ca(HCO3)2溶液中加入过量澄清石灰水 Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致,将锌块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 汽车尾气中除含有NOx,还含有PM2.5容易形成雾霾,“雾霾”的分散质微粒相同 | |
| C. | 双氧水、高锰酸钾溶液可以消灭病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com