
| A. | 1L0.2mol/L CaCl2溶液中含Cl-数为0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,体积为11.2L | |
| C. | 3.01×1023个水分子的摩尔质量为9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的数目相同 |
分析 A、1L0.2mol/L CaCl2溶液中含Cl-的物质的量为:1L×0.2mol/L×2=0.4mol,结合N=nNA求解;
B、状况不知,不清楚气体摩尔体积;
C、根据n=$\frac{N}{{N}_{A}}$,m=nM进行计算;
D、O2和O3都是由氧原子构成.
解答 解:A、1L0.2mol/L CaCl2溶液中含Cl-的物质的量为:1L×0.2mol/L×2=0.4mol,结合N=nNA=0.4mol×6.02×1023,故A错误;
B、状况不知,不清楚气体摩尔体积,故B错误;
C、根据n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,m=nM=0.5mol×18g/mol=9g,所以质量为9g,故C错误;
D、O2和O3都是由氧原子构成,所以等质量氧气和臭氧所含原子数目相同中,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:选择题
已知:  | |
步骤: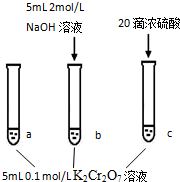 | 现象: 待试管b中颜色不变后与试管a比较,溶液颜色变浅. 滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深. |
| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
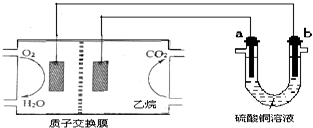
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | a极是铜,b极是铁时,硫酸铜溶液浓度减小 | |
| C. | a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的7/2 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液和Ca(OH)2溶液 | B. | Na2O和H2O | ||
| C. | Na2SO4溶液和CuCl2溶液 | D. | Na和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2CO3溶液中,c(OH)-=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则对于同温、同体积、同pH的HCN和HClO分别与Na0H恰好完全反应时,消耗NaOH的物质的量:HClO<HCN | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液:c(Na+)>c(CH3COO-)>C(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
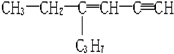 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为x,在同一直线上的碳原子数为y一定在同一平面上的碳原子数为z,则x、y、z分别为( )| A. | 5,6,4 | B. | 5,3,6 | C. | 5,4,8 | D. | 5,3,5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol•L-1 NaOH溶液 | pH=11NaOH溶液 | 0.1mo•L-1 CH3COOH 溶液 | pH=3 CH3COOH 溶液 |
| A. | ②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 由水电离出的c(OH-):①>③ | |
| C. | ③稀释到原来的100倍后,pH与④相同 | |
| D. | ①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com