
已知:  | |
步骤: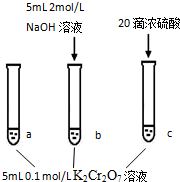 | 现象: 待试管b中颜色不变后与试管a比较,溶液颜色变浅. 滴加浓硫酸,试管c温度略有升高,溶液颜色与试管a相比,变深. |
| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
分析 A.反应中元素化合价没有变化,不属于氧化还原反应;
B.试管b中溶液颜色不变的目的是使反应到达平衡;
C.加入氢氧化钠溶液,可能是增大氢氧根离子浓度使平衡正向移动;
D.增大氢离子浓度、温度升高均使平衡逆向移动.
解答 解:A.反应中元素化合价没有变化,不属于氧化还原反应,故A错误;
B.试管b中溶液颜色不变的目的是使反应到达平衡,且可逆反应中反应物不能完全转化,故B错误;
C.加入氢氧化钠溶液,可能是增大氢氧根离子浓度使平衡正向移动,不能证明减小生成物浓度使平衡正向移动,故C正确;
D.增大氢离子浓度、温度升高均使平衡逆向移动,无法说明影响平衡的主要因素是温度,故D错误,
故选:C.
点评 本题考查化学平衡元素因素及实验探究,难度中等,C选项为易错点,正向反应本质是结合氢氧根离子.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
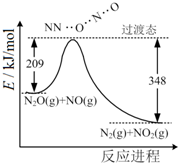
| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
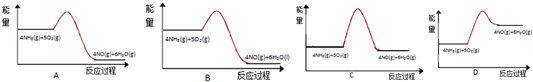
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 氯气和溴化钠溶液反应:C12+2Br-→2C1-+Br2 | |
| C. | 氢氧化钡和稀硫酸反应:SO42-+Ba2+→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | 硫酸 | D. | KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.2mol/L CaCl2溶液中含Cl-数为0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,体积为11.2L | |
| C. | 3.01×1023个水分子的摩尔质量为9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的数目相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com