
下列递变规律正确的是:
A.HClO4、H2SO4、H3PO4的酸性依次增强 B.P、S、Cl最高正价依次升高
C.HCl、HBr、HI的稳定性依次增强 D.锂、钠、钾的金属性依次增强
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
|
|

下列有关说法正确的是
A.在有机物X的1H核磁共振谱图中,有4组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
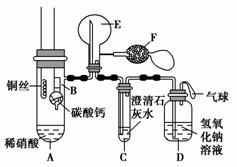
实验操作及现象:
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为___________________________________;
操作Ⅰ的目的是_________________________________________________;
D装置的作用是_________________________________________________。
(2)C装置中白色沉淀的化学式是___________________________________,
操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是_________________________________________________________________。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是_____________________ _________________________________________________________________。
(4)E装置内气体颜色逐渐加深的原因是__________________________ ________________________________________ _________________________。
_________________________。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明)________________________ _________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D为 。(填元素符号)
(2)D的最高价氧化物的水化物的化学式是 ,E的电子式是 。
(3)写出由A、B组成的化合物与E反应的化学方程式: 。
(4)请用电子式表示出C和D形成的化合物F的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A.原子半径:Z>R>W
B.W的气态氢化物稳定性强于R的气态氢化物
C.XW4分子中各原子均满足8电子结构
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是
A. 三氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==4NH4++AlO2—+2H2O
B. 4 mol/L的NaAlO2溶液和7 mol/L的HCl溶液等体积互相均匀混合:
4AlO2—+7H++H2O = 3Al(OH)3↓+Al3+
C. 在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+ = 5Pb2++2MnO4—+2H2O
D. 将数滴0.1 mol/L的Na2CO3溶液缓缓滴入0.1 mol/L 25 mL盐酸溶液中:2H++ CO32— =CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
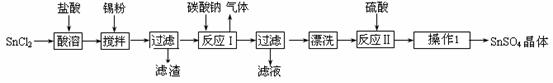
查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。请回答下列问题:
(1)操作Ⅰ步骤是 ▲ 。
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 ▲ 。
(3)加入Sn粉的作用有两个:①调节溶液pH ② ▲ 。
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 ▲ 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 ▲ 。
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.190 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液25.00 mL。锡粉中锡的质量分数是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com