
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
分析 若要使溴水的颜色变浅,可以通过改变条件使化学平衡向正反应方向移动,也可能加入能和溴发生反应的某些物质,结合溴的性质分析解答.
解答 解:A.该反应中没有气体参加或生成,改变加压对该平衡无影响,所以不能使溴水颜色变浅,故A错误;
B.加入氟化钠晶体,氢溴酸的酸性大于氢氟酸,所以氢溴酸和氟化钠反应,促进平衡向正反应方向移动,所以能使溴水颜色变浅,故B正确;
C.通入二氧化硫,溴具有强氧化性,在水溶液溴能氧化二氧化硫生成硫酸,自身被还原生成氢溴酸,所以能使溴水颜色变浅,故C正确;
D.加入NaI晶体,与溴水发生置换反应生成紫色的碘颜色变深,故D错误;
故选BC.
点评 本题考查了氧化还原反应、化学平衡移动,明确物质的性质及影响化学平衡移动的因素是解本题关键,易错选项是C,注意二氧化硫能和溴发生氧化还原反应而使化学平衡移动,为易错点.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
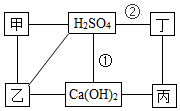 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
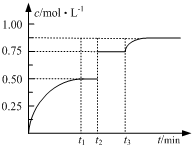 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:| A. | 若t1=2,则反应在0~2 min内的平均速率为v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H>0 | |
| C. | 若t1时刻后向体系中加入A、B、C各1 mol,则υ(正)>υ(逆) | |
| D. | 温度不变,若起始向容器中加入1 mol A、1 mol B、2 mol D,则达平衡时A的转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 镁片插入硝酸银溶液中:Mg+2Ag+═Mg2++2Ag | |
| B. | 常温下将氯气通入水中:Cl2+H2O?H++Cl-+HClO | |
| C. | 氯气与碘化钾溶液反应:Cl2+I-═2Cl-+I | |
| D. | 大理石加到盐酸中反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com