
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
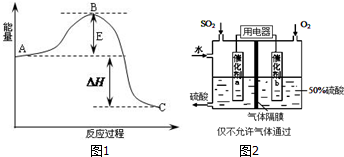
分析 (1)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1;E表示正反应的活化能; 升高温度平衡向吸热方向移动,根据二氧化硫转化率大小判断反应热;此时浓度商=$\frac{0.{4}^{2}}{0.{3}^{2}×0.1}$=17.8>16,据此判断平衡移动方向;
(2)溶液中存在c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度导致溶液呈酸性;
(3)根据图知,通入二氧化硫的电极上二氧化硫随着生成硫酸根离子,SO2、O2和水形成硫酸溶液的浓度为50%,求出SO2和水的质量比.
解答 解:(1)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则△H=198kJ/mol,
E表示正反应的活化能;根据表中数据知,压强一定时,温度升高,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;此时浓度商=$\frac{0.{4}^{2}}{0.{3}^{2}×0.1}$=17.8>16,平衡正向移动,则v(正)>v(逆),
故答案为:-198; 正反应的活化能;压强一定时,温度升高,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;>;
(2)NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于 c(SO32-)>c(H2SO3),说明HSO3-电离程度大于水解程度导致溶液呈酸性,则c(H+)>c(OH-),
故答案为:>; NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于 c(SO32-)>c(H2SO3),所以电离程度大于水解;
(3)根据图知,通入二氧化硫的电极上二氧化硫随着生成硫酸根离子,负极反应式为SO2+2H2O-2e-=SO42-+4H+;
设:SO2和水的质量分别为a、b
SO2 +H2O?H2SO3
64 18 82
a $\frac{18a}{64}$ $\frac{82a}{64}$
2H2SO3 +O2═2H2SO4
164 196
$\frac{82a}{64}$ $\frac{98a}{64}$
则:硫酸溶液的质量百分数为 $\frac{\frac{98a}{64}}{\frac{98a}{64}+b-\frac{18a}{64}}$×100%=50%,
整理可得 a:b=16:29,
故答案为:SO2+2H2O-2e-=SO42-+4H+;16:29.
点评 本题考查化学平衡计算、盐类水解、原电池原理等知识点,侧重考查学生分析判断及计算能力,本题注意把握原电池的工作原理,易错点为(3),注意计算方法的体会,难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O所含有的原子数为NA | |
| B. | 32gO2含有的氧原子数为2NA | |
| C. | 常温常压下,11.2 LCl2 所含的分子数为0.5NA | |
| D. | 1L0.1mol/LNaCl溶液中所含的Na+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
| A. | 容器Ⅳ中c(D)=0.4 mol/L | |
| B. | t2时容器Ⅱ中v(正)>v(逆) | |
| C. | 容器Ⅰ中平均反应速率v(B)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| D. | 容器Ⅲ中反应至平衡时吸热20 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com