
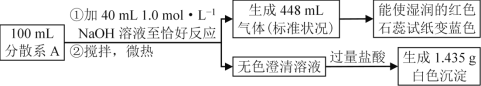
【题目】某固体样品可能含有Fe3+、NH4+、Ag+、NO3-、Cl中的若干种离子,为确定该样品的组成,将样品用蒸馏水配成100mL分散系A,进行了如下实验(假设气体全部逸出):
下列说法正确的是( )
A.该样品中肯定含有NH4NO3、AgNO3
B.溶液A中肯定没有Fe3+、Cl
C.溶液A可能含有Cl
D.溶液A中NO物质的量浓度是0.5mol·L1
【答案】C
【解析】
100mL分散系A加入40mL 1mol/L的氢氧化钠溶液,恰好完全反应,生成448mL氨气和无色澄清溶液,氨气的物质的量是![]() 0.02mol,则原溶液一定含有NH4+,一定不含Fe3+;向无色澄清溶液中加入过量盐酸,生成1.435g白色沉淀,则白色沉淀一定是AgCl,物质的量是
0.02mol,则原溶液一定含有NH4+,一定不含Fe3+;向无色澄清溶液中加入过量盐酸,生成1.435g白色沉淀,则白色沉淀一定是AgCl,物质的量是![]() 0.01mol,则无色澄清溶液中含有0.01mol
0.01mol,则无色澄清溶液中含有0.01mol![]() ,原溶液含有0.04mol NH4+,0.01mol Ag+,AgCl能溶于氨水,原溶液可能含Cl、NO;
,原溶液含有0.04mol NH4+,0.01mol Ag+,AgCl能溶于氨水,原溶液可能含Cl、NO;
根据以上分析,A. 该样品中可能含有NH4Cl、AgNO3,故A错误;
B. AgCl能溶于氨水,溶液A可能含Cl,故B错误
C. AgCl能溶于氨水,溶液A可能含Cl,故C正确;
D. 若溶液中含有Cl,根据电荷守恒,溶液A中NO3-物质的量浓度小于0.5mol·L1,故D错误。
选C。


科目:高中化学 来源: 题型:
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在周期表中位置,用化学符号回答下列问题。
周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中:化学性质最不活泼的是__;金属性最强的是:__,最高价氧化物的水化物酸性最强的酸是__,最高价氧化物的水化物碱性最强的碱的电子式__。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是__。
(3)A、B、C三种元素按离子半径由大到小的顺序排列为__。
(4)F的最常见氢化物的电子式__;该氢化物在常温下跟B发生反应的化学方程式是__。
(5)C元素跟G元素形成的化合物的电子式是__,用电子式表示其形成过程为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用NaCl为原料制备高氯酸,实验按流程如下所示:
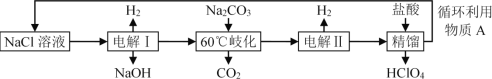
下列说法不正确的是( )
A.电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成
B.“60℃歧化”的反应为:3Cl2+3CO32-=5Cl+ClO3-+3CO2
C.电解Ⅱ中阳极反应式为:ClO3-+2OH-2e=ClO4-+H2O
D.循环利用物质A的成分是NaCl、NaClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤
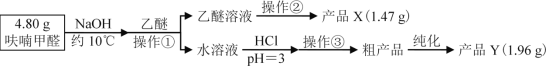
Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
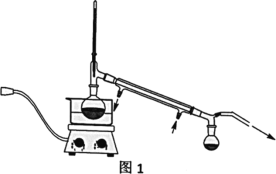
Ⅳ、实验装置
V、分析与思考,回答下列问题:
(1)操作①名称___;产品Y为___。
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
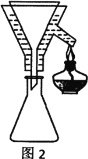
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g)![]() xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com