
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol M气体和3 mol N气体混合发生下列反应2M(g)+ 3N(g)![]() xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
xQ(g)+ 3R(g),该反应达到平衡时生成2.4 mol R,并测得Q浓度为0.4 mol/L,下列叙述正确的是
A.x值为2
B.混合气体的密度增大
C.平衡时N的浓度为 0.6 mol/L
D.N的转化率为80%
【答案】D
【解析】
试题分析:A.平衡时生成的Q的物质的量为0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,0.8mol:2.4mol=x:3,解得x=1,A项错误;B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ=m÷V可知混合气体的密度不变,B项错误;C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的N的物质的量为2.4mol,平衡时N的物质的量为3mol-2.4mol=0.6mol,N的平衡浓度为0.6mol÷2L==0.3mol/L,C项错误;D.参加反应的N的物质的量为2.4mol,则N的转化率为2.4mol÷3mol×100%=80%,D项正确;答案选D。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组物质: ①金刚石和石墨 ②H、D和T ③苯和乙苯 ④CH3(CH2)2CH3 和(CH3)2CHCH3中,互为同位素的是(填序号,下同) ,互为同素异形体的是 ,互为同系物的是 ,属于同分异构体的是 。
(2)现有CH4、C2H6、C2H4、C3H6、C6H6五种有机物,质量相同时,完全燃烧消耗O2的量最多的是 (填分子式,下同),完全燃烧所生成的CO2最多的是 ,生成的水最多的是 ;120 ℃,101 kPa下,将上述五种有机物分别与足量的空气混合,引燃反应后恢复到原来的状态,气体体积不变的是 与 。
(3) 两种气态烃组成的混合物6.72L(标准状况),完全燃烧生成0.48molCO2和10.8gH2O,则该混合烃中一定含有 (化学式),若另一种烃一定条件下最多能与等物质的量的H2完全加成,则该烃的名称为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲和乙通过化合反应制备丙,如图是三种分子的模型图,根据微观示意图得出的结论错误的是
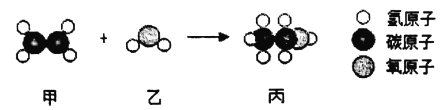
A.甲的化学式为C2H4
B.保持乙化学性质的最小微粒是水分子
C.化学反应前后分子的种类都发生了改变
D.乙和丙都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成.回答下列问题:
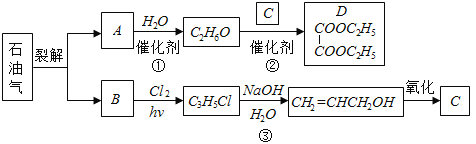
(1)B和A为同系物,B的结构简式为 .
(2)反应①的化学方程式为 ,其反应类型为 .
(3)反应③的反应类型为 .
(4)C的结构简式为 .
(5)反应②的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
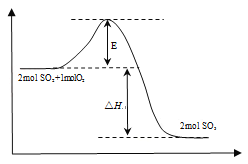
【题目】2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,是工业制硫酸的主要反应之一。
2SO3(g) ΔH<0,是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如右图所示:E的大小对该反应的反应热有无影响_______(填“有”或“无”),该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_______。
A.△H B.E C.△H – E D.△H + E
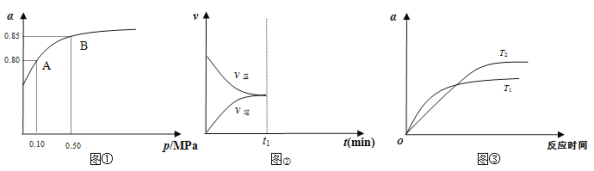
(2)某温度下,甲同学将2 mol SO2和1 mol O2置于密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图①所示,若A点二氧化硫的平衡浓度为0.04 mol/L,则容器的体积为_______L;图①中B点SO2、O2、SO3的平衡浓度之比为________________;反应到达平衡时,时间t1时缩小容器体积,请在图②中画出时间t1之后反应速率变化图像;图③为压强等于0.50 MPa时不同温度下SO2转化率与温度关系图,图中T2_____T1(填写“大于”或“小于”)
(3)在2 L的密闭容器中,乙同学投入2 mol SO2和b mol O2,25 min时达到平衡,如下图所示,在35 min时,改变某一条件,经过一段时间后,70 min时,反应再次达到平衡,回答下列问题:
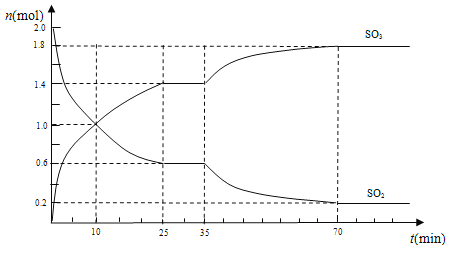
①10 min时,v(SO2)正________v(SO3)逆(填“>”“<”或“=”)
②求0~10 min时,v(O2)=______________
③反应开始至35 min时,测得反应共放热138.6 kJ,则反应2SO2(g)+O2(g)![]() 2SO3(g)△H=____kJ/mol
2SO3(g)△H=____kJ/mol
④35 min时,改变的条件可能是___________________
a.加入更多的V2O5
b.从容器中分离出少量O2
c.投入一定量的SO3
d.降低反应温度
e.往容器中加入N2,使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA
B.含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间
C.在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA
D.5NH4NO3![]() 4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
4N2↑+2HNO3 +9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列有关叙述正确的是( )
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6g NO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
A.①④⑦ B.②⑤⑧ C.②③④⑥ D.①②④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com