
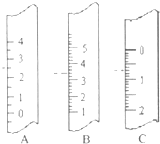
 (1)如图分别是温度计、量筒、滴定管的一部分,则:
(1)如图分别是温度计、量筒、滴定管的一部分,则:| c(标准)×V(标准) |
| V(待测) |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
| 空 |
| 燃 |
| 空 |
| 燃 |
| 光合作用 |
| ||
| △ |
| ||
| △ |
| ||
| △ |
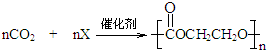 ,则X的结构简式为
,则X的结构简式为

查看答案和解析>>
科目:高中化学 来源: 题型:
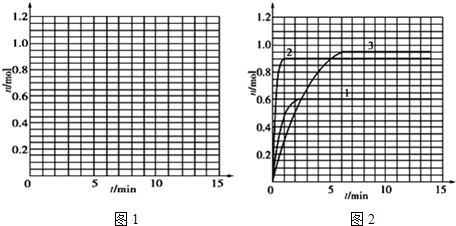
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
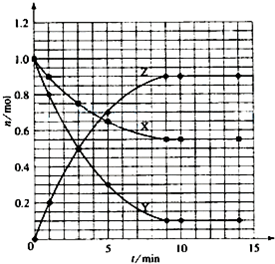

查看答案和解析>>
科目:高中化学 来源: 题型:

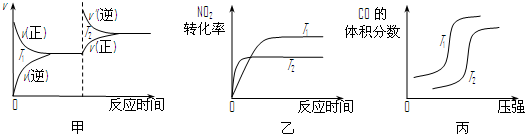
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 的物质计量数;X1、X2表示不同温度或压强),某物理量Y随时间(t)变化的情况如图所示,
的物质计量数;X1、X2表示不同温度或压强),某物理量Y随时间(t)变化的情况如图所示,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com