
【题目】液晶高分子材料应用广泛。新型液晶基元--化合物Ⅳ的合成线路如下:
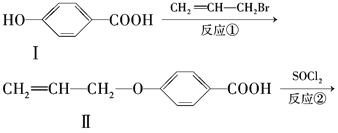
(1)化合物Ⅰ的分子式为________,1mol化合物Ⅰ最多可与________molNaOH反应。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为____________________(注明条件)。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中1种同分异构体的结构简式:____________________________________。
(4)下列关于化合物Ⅱ的说法正确的是________。
A.属于烯烃
B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应
D.能使溴的四氯化碳溶液褪色
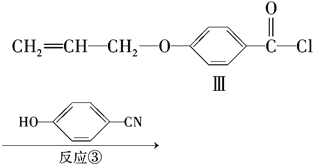
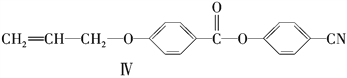
(5)反应③的反应类型是________。在一定条件下,化合物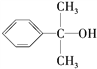 也可与Ⅲ发生类似反应③的反应生成有机物V。V的结构简式是_____________________________。
也可与Ⅲ发生类似反应③的反应生成有机物V。V的结构简式是_____________________________。
【答案】 C7H6O3 2 CH2=CH-CH2Br+NaOH![]() CH2=CH-CH2OH+NaBr
CH2=CH-CH2OH+NaBr  、
、 、
、 CD 取代反应
CD 取代反应 
【解析】试题分析:(1)化合物Ⅰ中含有羧基和酚羟基,故1 mol化合物Ⅰ可以和2 mol NaOH反应。
(2)CH2=CH—CH2Br因含有官能团“-Br”而具有卤代烃的性质,因此与NaOH水溶液在加热的条件下可发生取代反应生成CH2=CH—CH2OH;
(3)能发生银镜反应必含—CHO,结合分子式可知,还必须含酚羟基,结合苯环上的一溴代物只有两种,利用对称性即可写出符合条件的同分异构体。
(4)化合物Ⅱ中含有羧基,不属于烃,故A错误;化合物Ⅱ中没有酚羟基,不能与FeCl3溶液反应,故B错误。分子中含有碳碳双键,具有烯烃性质,因此在一定条件下可发生加聚反应,C正确;可与溴的四氯化碳溶液发生加成反应而使溶液褪色,D正确。
(5)利用化合物Ⅲ. Ⅳ的结构简式可知反应③是反应物中![]() 中“
中“![]() ”取代化合物Ⅲ中“—Cl”生成化合物Ⅳ,同时还有HC1生成;类比
”取代化合物Ⅲ中“—Cl”生成化合物Ⅳ,同时还有HC1生成;类比 与
与![]() 的结构特点,可见生成化合物V应是“
的结构特点,可见生成化合物V应是“ ”取代化合物Ⅳ中“—Cl”生成的有机物。
”取代化合物Ⅳ中“—Cl”生成的有机物。


科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系: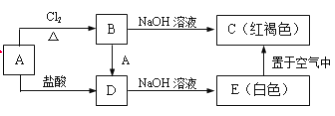
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学。下列是中学化学中一些常见的实验装置,按要求回答下列问题:
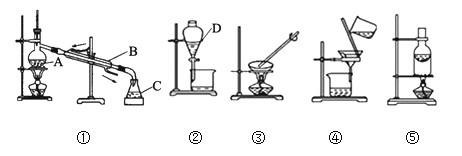
(1)写出仪器名称:D__________。
(2)装置①中的错误是_______________________________。
(3)分离下列混合物的实验操作中,用到实验装置②的是______,用到装置⑤的是________(填字母代号)。
A.水和泥沙的混合物 B.水和酒精的混合物
C.水和四氯化碳的混合物 D.淀粉胶体和氯化钠溶液
E.固体氯化钠和碘单质 F.碳酸钙和碳酸钠粉末
(4)粗盐提纯所需装置为_________和___________,操作过程中均要用到玻璃棒,玻璃棒的作用分别是________________、_________________。
(5)装置②可用于CCl4萃取碘水中的碘,如何检验萃取后的碘水中还存在碘单质_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中,不利于实现让海南“天更蓝,山更绿,水更清”目标的是( )
A.污水未经处理直接排入大海B.推广使用清洁能源
C.植树进林,提高森林覆盖率D.推广使用无磷洗涤剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如右下图所示。下列有关绿原酸的说法中正确的是( )

①绿原酸分子中含有3种官能团
②1 mol绿原酸最多能与7molNaOH发生反应
③绿原酸能发生取代反应、加成反应和消去反应
④绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同
A. ①③ B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应 KMnO4+ HCl= MnCl2+ KCl+ Cl2↑+ H2O中,MnCl2为易溶于水的强电解质,回答下列问题:
①氧化剂是___________,还原剂是__________;
②配平上述方程式并用双线桥法标明电子转移的方向和数目:______________;
③写出上述反应的离子方程式:_________________________________________;
④若生成71gCl2,被氧化的HCl是_________________g。
(2)单质铁与稀HNO3可发生多种反应,当8/3n(Fe)<n(HNO3)≤4n(Fe)时,反应方程式可用下列通式表示:aFe+bHNO3(稀)=cNO十dFe(NO3)2+eFe(NO3)3十fH2O。
①假设a=16,且b、c、d、e、f均取正整数时,共有_______组系数配比。
②若a、b、c、d、e、f符合上述系数的配比关系,则b与C的关系为:b=____c。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A. Cu2+、NO3- 、OH- B. H+、A13+、SO42-
C. OH-、Fe2+、NO3- D. Na+、H+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号_____________。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式___________________。
③画出甲元素的原子结构示意图_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可制取有广泛用途的Na2FeO4:Fe+2H2O+ 2NaOH![]() Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是
Na2FeO4+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeOH42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。下列说法不正确的是

A. a是电源的正极
B. 电解一段时间后,c(OH-)降低的区域在阴极室
C. 电解过程中,阳极发生的电极方程式为Fe+8OH--6e-==FeO42-+4H2O
D. 如图2,N点c(Na2FeO4)低于最高值的原因是氢氧化钠溶液浓度过高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com