
【题目】(1)在反应 KMnO4+ HCl= MnCl2+ KCl+ Cl2↑+ H2O中,MnCl2为易溶于水的强电解质,回答下列问题:
①氧化剂是___________,还原剂是__________;
②配平上述方程式并用双线桥法标明电子转移的方向和数目:______________;
③写出上述反应的离子方程式:_________________________________________;
④若生成71gCl2,被氧化的HCl是_________________g。
(2)单质铁与稀HNO3可发生多种反应,当8/3n(Fe)<n(HNO3)≤4n(Fe)时,反应方程式可用下列通式表示:aFe+bHNO3(稀)=cNO十dFe(NO3)2+eFe(NO3)3十fH2O。
①假设a=16,且b、c、d、e、f均取正整数时,共有_______组系数配比。
②若a、b、c、d、e、f符合上述系数的配比关系,则b与C的关系为:b=____c。
【答案】KMnO4 HCl  2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 73 5 4
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 73 5 4
【解析】
(1)①反应中高锰酸钾中+7价锰降为氯化锰中+2价,降价数为5,得到5mol电子,氧化剂是KMnO4。氯化氢中-1价氯化合价升高为氯气中0价,升高为1,还原剂是HCl;
②生成1mol氯气失去2mol电子,消耗1mol高锰酸钾得到5mol电子,依据氧化还原反应中得失电子守恒可知,高锰酸钾系数为2,氯气系数为5,依据原子个数守恒,氯化锰系数为2,氯化钾系数为2,依据氯原子个数守恒氯化氢系数为16,水分子系数为8,所以配平上述方程式并用双线桥法标明电子转移的方向和数目为 ;
;
③根据化学方程式可知上述反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
④71g Cl2物质的量为71g÷71g/mol=1mol,依据方程式可知生成1mol氯气转移2mol电子,被氧化的氯化氢物质的量为2mol,质量是2mol×36.5g/mol=71g。
(2)①假设a=16,且b、c、d、e、f均取正整数时,根据铁原子守恒可知d+e=16,根据电子得失守恒可知2d+3e=3c,解得e=3c-32。由于1≤e<16,则1≤3c-32<16,解得11≤c<16,所以c可以是11、12、13、14、15,因此共有5组系数配比。
②若a、b、c、d、e、f符合上述系数的配比关系,根据氮原子守恒可知c+2d+3e=b,根据电子得失守恒可知2d+3e=3c,则b与c的关系为:b=4c。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种易溶于水的白色固体,分别由Na+、Ba2+、Cu2+、Ag+、Cl-、SO42-、CO32-、NO3-中的一种阳离子和一种阴离子组成(同一种离子只存在一种物质中)。某课外小组做了以下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断盐的化学式分别为:A__________;D__________。
(2)写出下列反应的离子方程式:
①B+D→:________________;③C+HCl→气体:_______________。
(3)在作实验反思时,有同学提出:如果溶液中同时存在CO32- 和Cl-,CO32- 会对Cl- 的检验产生干扰。为了确定该溶液中是否存在Cl-,该小组同学进行了如下探究实验:
 _________________________________
_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
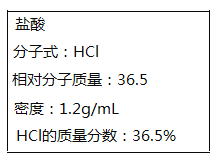
(1)写出锌粉与盐酸反应的离子方程式______________。
(2)求原浓盐酸的物质的量浓度c=____________。
(3)计算出m=___________。
(4)反应中生成的H2可以和标准状况下______mL的O2恰好完全反应。
(5)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
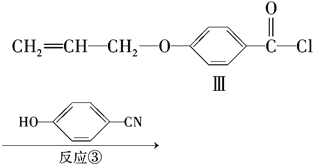
【题目】液晶高分子材料应用广泛。新型液晶基元--化合物Ⅳ的合成线路如下:
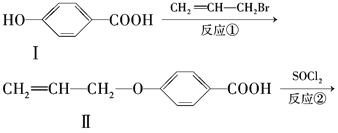
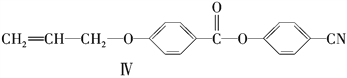
(1)化合物Ⅰ的分子式为________,1mol化合物Ⅰ最多可与________molNaOH反应。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为____________________(注明条件)。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中1种同分异构体的结构简式:____________________________________。
(4)下列关于化合物Ⅱ的说法正确的是________。
A.属于烯烃
B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应
D.能使溴的四氯化碳溶液褪色
(5)反应③的反应类型是________。在一定条件下,化合物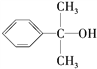 也可与Ⅲ发生类似反应③的反应生成有机物V。V的结构简式是_____________________________。
也可与Ⅲ发生类似反应③的反应生成有机物V。V的结构简式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 同分异构体之间分子式相同,其式量也一定相等;式量相等的物质一定是同分异构体
B. 某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃
C. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为CH3CH2OH
D. 分子式为C8H10的芳香烃有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
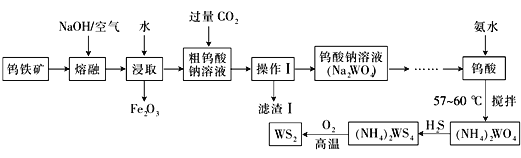
请回答下列问题:
(1)已知:W元素的原子序数是74,请写出W元素在周期表中的位置:_________________
(2)操作Ⅰ中用到的玻璃仪器有________________________________
(3)写出FeWO4在碱熔过程中发生反应的化学方程式:_________________________________
(4)滤渣Ⅰ中主要成分的形成可用离子方程式表示为:_________________________________
(5)钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,其原理为:W(s)+2I2(g)![]() WI4(g)下列说法正确的有_______
WI4(g)下列说法正确的有_______
A. 灯管内的I2可以循环使用
B. WI4在灯丝上分解,产生的W又在灯丝上沉积
C. 温度升高时,WI4的分解速率加快,而W和I2的合成速率减慢
D. WI4在灯管壁上分解,使灯管寿命延长
(6)已知常温下,Ksp(CaWO4) =1×10-10,浓度为x mol/L的Na2WO4溶液与浓度为1×10-4 mol/L的CaCl2溶液按体积比2:1混合,产生CaWO4沉淀,则x≥___________
(7)已知生成二硫化钨的化学方程式为:2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液的说法不正确的是
A. 加水稀释Na2S溶液过程中,水电离出的c(H+) c(OH-)逐渐减小
B. pH=5的NH4Cl溶液,用蒸馏水稀释10倍后,溶液的pH<6
C. pH=2的一元酸HA溶液与pH=12的NaOH溶液等体积混合后,c(Na+)<c(A-)
D. pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液中c(NH![]() ):①=③>②
):①=③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A:
①由C、H、O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%
②下图是该有机物的质谱图,
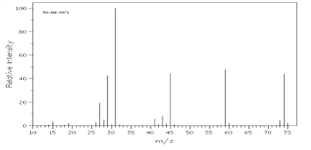
③A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰。
④A的核磁共振氢谱有两个峰。
请回答:
(1)A的实验式(最简式)为________,相对分子质量为_______,分子式为_____________。
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”)______,为什么_______。
(3)A的结构简式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com