
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为A![]() ,还含有F
,还含有F![]() 、FeO、Si
、FeO、Si![]() )中.工业上用铝土矿制备铝的某种化合物的工艺流程如下。
)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,便于后期形成Fe(OH![]() 沉淀,所得滤液B显酸性。
沉淀,所得滤液B显酸性。
①检验滤液A中含有F![]() 的试剂为_____
的试剂为_____
②检验滤液B中不含有F![]() 的实验操作方法为_____。
的实验操作方法为_____。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为_____(填选项编号)。
a.氢氧化钠溶液 b.硫酸溶液 c.二氧化碳 d.氨水
(2)矿渣中一定含有的物质是_____(填化学式)。焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。
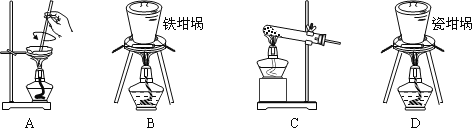
【答案】KSCN溶液或者硫氰化钾溶液 取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含亚铁离子 d SiO2 B
【解析】
图示工艺流程为:铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)加入稀盐酸,得到滤渣为二氧化硅,滤液中含有铁离子、亚铁离子和氯离子;加入漂白液后亚铁离子氧化成铁离子,铁离子水解生成氢氧化铁沉淀;滤液B为氯化铝溶液;二氧化硅与氢氧化钠在铁坩埚中焙烧生成硅酸钠。
(1)①检验是否含铁离子,可加入KSCN溶液,如溶液变红色,可说明含有铁离子,
故答案为:KSCN溶液或者硫氰化钾溶液;
②滤液B可能含有铁离子或亚铁离子,可取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含亚铁离子,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入少量氯水,仍然不变红,说明滤液B中不含亚铁离子;
③滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出,
a.氢氧化钠溶液可以沉淀铝离子但过量后会溶解氢氧化铝,氢氧化钠不是最佳试剂,故a错误;
b.硫酸溶液不与铝离子反应,故b错误;
c.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故c错误;
d.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故d正确;
故答案为:d;
(2)二氧化硅与盐酸不反应,矿渣中一定含有的物质是SiO2,
A.蒸发皿中含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故A错误;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,可在铁坩埚中用SiO2和NaOH焙烧制备硅酸钠,故B正确;
C.玻璃中含二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故C错误;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,不能用于SiO2和NaOH焙烧制备硅酸钠,故D错误;
故答案为:SiO2;B。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
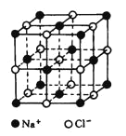
【题目】一种离子晶体的晶胞如图其中阳离子A以红球表示,阴离子B以黑球表示。

(1)每个晶胞中含A离子的数目为___________,含B离子数目为____________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是_________;
(3)阳离子周围距离最近的阴离子数为_______,阴离子周围距离最近的阳离子数为________。
(4)已知A的离子半径为rm,则该晶胞的体积是_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①准确称取mg干燥后的NaCl固体细粒并转移到定容仪器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,
计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用_______________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定管_____________,理由是__________。
(3)能否用水代替苯_________,理由是_____________________。
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德常数NA的表达式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
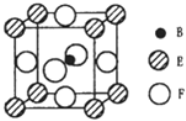
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是( )
A. SO32- 和NO2-B. NO3- 和SO32-C. ![]() 和ClO3-D. PO43- 和SO32-
和ClO3-D. PO43- 和SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺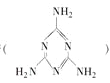 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化
B. 一个分子中共含有15个σ键
C. 属于极性分子,故极易溶于水
D. 分子内既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
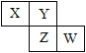
A. 原子半径:Z > Y > XB. 氢化物稳定性:X > Y
C. 氢化物沸点:Z > YD. 最高价氧化物对应的水化物酸性:W > Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com