
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①准确称取mg干燥后的NaCl固体细粒并转移到定容仪器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,
计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用_______________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定管_____________,理由是__________。
(3)能否用水代替苯_________,理由是_____________________。
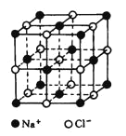
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德常数NA的表达式为_______________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维拉帕米(又名异搏定)是治疗心绞痛和原发性高血压的药物,合成路线中某一步骤如图所示。
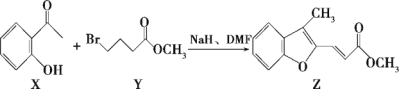
下列说法中正确的是
A.X中所有原子可能在同一平面上B.含苯环和羧基的X的同分异构体有3种
C.Z的分子式为C13H10O3D.1 mol Z最多可与2 mol Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
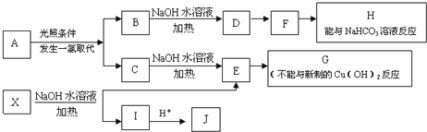
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为______;(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为______;
(3)E与H反应的化学方程式是________;反应类型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是______;
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式_______;
①与FeCl3溶液作用显紫色
②与新制Cu(OH)2悬浊液作用产生红色沉淀
③苯环上的一卤代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸钠晶体(![]() )的物质的量为1.5mol,请计算填空:
)的物质的量为1.5mol,请计算填空:
(1)所含钠离子的物质的量是________,钠离子的数目是________。
(2)所含硫酸根离子的物质的量是________,所含氧原子的数目是________。
(3)硫酸钠晶体(![]() )是_______________________(填“纯净物”或“混合物”)
)是_______________________(填“纯净物”或“混合物”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL 0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是
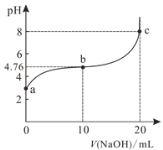
A.a点溶液的pH为2.88
B.b点溶液中:c(Na+)>c(A-)>c(HA)
C.b、c之间一定存在c(Na+)=c(A-)的点
D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2![]() 2SO3的说法不正确的是
2SO3的说法不正确的是
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为A![]() ,还含有F
,还含有F![]() 、FeO、Si
、FeO、Si![]() )中.工业上用铝土矿制备铝的某种化合物的工艺流程如下。
)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,便于后期形成Fe(OH![]() 沉淀,所得滤液B显酸性。
沉淀,所得滤液B显酸性。
①检验滤液A中含有F![]() 的试剂为_____
的试剂为_____
②检验滤液B中不含有F![]() 的实验操作方法为_____。
的实验操作方法为_____。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为_____(填选项编号)。
a.氢氧化钠溶液 b.硫酸溶液 c.二氧化碳 d.氨水
(2)矿渣中一定含有的物质是_____(填化学式)。焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。
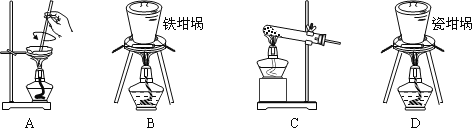
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃的球棍模型如图所示:
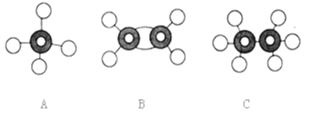
(1)A、B、C的分子式分别是________、________、________;
(2)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测反应前后气体体积,没有发生变化,这两种气态烃是________;
(3)写出B转化为C的化学方程式:_________________________________________________;
(4)除去气体C中混有的少量B可选用的试剂名称是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com