
【题目】某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
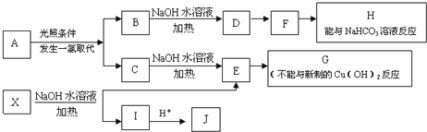
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为______;(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为______;
(3)E与H反应的化学方程式是________;反应类型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是______;
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式_______;
①与FeCl3溶液作用显紫色
②与新制Cu(OH)2悬浊液作用产生红色沉淀
③苯环上的一卤代物有2种
【答案】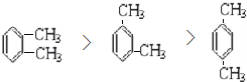 (酚)羟基、羧基
(酚)羟基、羧基 ![]() 酯化反应(或取代反应) 聚苯乙烯
酯化反应(或取代反应) 聚苯乙烯 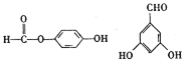
【解析】
某芳香烃A,分子式为C8H10,可能为乙苯或二甲苯,A与氯气在光照条件下发生侧链上的一氯取代反应生成两种不同物质B和C,说明A为乙苯,B最终产物H能与NaHCO3溶液反应,说明H具有酸性,则B为![]() ,C为
,C为![]() ,E为
,E为![]() ,H为
,H为![]() ,X分子式为C15H14O3,能使FeCl3溶液显紫色,说明结构中含有酚羟基,水解生成I和E,则X为酯,水解生成羧酸和醇,而E为醇,分子中不含酚羟基,J为酸,分子中含有羧基并有酚羟基,且两个取代基互为对位,结构为
,X分子式为C15H14O3,能使FeCl3溶液显紫色,说明结构中含有酚羟基,水解生成I和E,则X为酯,水解生成羧酸和醇,而E为醇,分子中不含酚羟基,J为酸,分子中含有羧基并有酚羟基,且两个取代基互为对位,结构为![]() ,据此分析解答。
,据此分析解答。
(1)乙苯的同分异构体为二甲苯,有邻二甲苯、间二甲苯和对二甲苯三种,三者的沸点高低顺序为邻二甲苯>间二甲苯>对二甲苯,故答案为: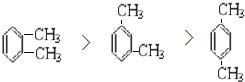 ;
;
(2)J为![]() ,分子中含有的含氧官能团为酚羟基和羧基,故答案为:(酚)羟基、羧基;
,分子中含有的含氧官能团为酚羟基和羧基,故答案为:(酚)羟基、羧基;
(3)E为![]() ,H为
,H为![]() ,二者在浓硫酸作用下加热发生酯化反应生成酯和水,反应方程式为:
,二者在浓硫酸作用下加热发生酯化反应生成酯和水,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;酯化反应(或取代反应);
;酯化反应(或取代反应);
(4)B为![]() ,C为
,C为![]() ,B、C的混合物在NaOH乙醇溶液中加热发生消去反应,可以生成同一种有机物K,则K为苯乙烯,苯乙烯发生加聚反应生成聚苯乙烯,故答案为:聚苯乙烯;
,B、C的混合物在NaOH乙醇溶液中加热发生消去反应,可以生成同一种有机物K,则K为苯乙烯,苯乙烯发生加聚反应生成聚苯乙烯,故答案为:聚苯乙烯;
(5)J为![]() ,J的同分异构体中:①与FeCl3溶液作用显紫色,说明结构中含有酚羟基;②与新制Cu(OH)2悬浊液作用产生红色沉淀,说明结构中含有醛基,可以是醛也可以是甲酸酯;③苯环上的一卤代物有2种,说明苯环结构中只含有两种性质不同的氢原子。符合条件的有:
,J的同分异构体中:①与FeCl3溶液作用显紫色,说明结构中含有酚羟基;②与新制Cu(OH)2悬浊液作用产生红色沉淀,说明结构中含有醛基,可以是醛也可以是甲酸酯;③苯环上的一卤代物有2种,说明苯环结构中只含有两种性质不同的氢原子。符合条件的有: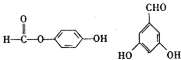 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】根据下列提供的一组物质回答问题:
①NH4Cl ②MgCl2 ③H2S ④Na2O2 ⑤MgO ⑥Cl2 ⑦NaOH ⑧H2O2 ⑨NH3 ⑩CO2
(1)既有极性共价键又有非极性共价键的是__(用序号表示)。
(2)既有离子键又有共价键的是__(用序号表示)。
(3)共价化合物有___(用序号表示)。
(4)CO2的电子式___;Na2O2的电子式__。
(5)用电子式表示MgCl2的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
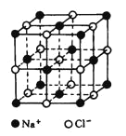
【题目】一种离子晶体的晶胞如图其中阳离子A以红球表示,阴离子B以黑球表示。

(1)每个晶胞中含A离子的数目为___________,含B离子数目为____________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是_________;
(3)阳离子周围距离最近的阴离子数为_______,阴离子周围距离最近的阳离子数为________。
(4)已知A的离子半径为rm,则该晶胞的体积是_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为______,表示其中和热的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。铈元素在自然界中主要以氟碳铈矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

(1)为了提高焙烧效率可以采取的措施有______________。(回答两条即可)
(2)假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式: ______。有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,其理由是:___________。
(3)常温下,当溶液中的某离子浓度≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到________时,即可视为Ce3+已完全沉淀。{Ksp[Ce(OH)3]=1.0×10-20}。
(4)向Ce(BF4)3中加入KCl溶液,该反应能发生的原因是____________________。
(5)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,用电解的方法可将上述吸收液中的NO2-转化为稳定的无毒气体,同时将Ce3+再生为Ce4+,其原理如图所示。

①NO2-从电解槽的________(填字母序号)口进入。
②每生成标准状况下11.2 L无毒气体,同时可再生Ce4+________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类正确的一组是( )
①液氨、液氧、干冰、纯碱均为化合物 ②盐酸、氢氧化铁胶体、空气、氨水均为混合物 ③氢氧化钾、小苏打、硫酸、烧碱均为电解质 ④碘酒、牛奶、豆浆、肥皂水均为胶体 ⑤![]() 、
、![]() 、
、![]() 、
、![]() 均为钠盐
均为钠盐
A.①和②B.②和③C.②和④D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①准确称取mg干燥后的NaCl固体细粒并转移到定容仪器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,
计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用_______________(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定管_____________,理由是__________。
(3)能否用水代替苯_________,理由是_____________________。
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如图),则用上述方法测得的阿伏加德常数NA的表达式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
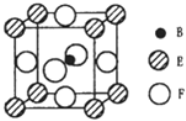
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com