
【题目】H、N、O、S、Ni、As为元素周期表中1~4周期元素。请回答下列问题:
(1)上述元素中第一电离能最大的元素符号是___________,电负性最大的元素的原子其价电子轨道表示式为___________。
(2)CH3NO2中C和N的原子轨道杂化方式分别为___________、___________。
(3)SO32-其空间构型为___________。写出一种与该酸根等电子体的微粒___________。
(4)NH3极易溶于水其原因除二者都为极性分子外,另一个重要原因是___________。
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。

①该晶体的化学式为___________,As原子的配位数为___________。
②已知晶胞参数a=360.2pm,c=500.9pm,此晶体的密度为___________g·cm-3。(写出计算式,NA为阿伏加德罗常数的值)
【答案】N ![]() sp3 sp2 三角锥形 AsO33-、ClO3- 、PCl3 NH3分子与水分子间形成氢键 NiAs 6
sp3 sp2 三角锥形 AsO33-、ClO3- 、PCl3 NH3分子与水分子间形成氢键 NiAs 6 ![]()
【解析】
(1)因为N的价电子排布式为2s22p3,处于半充满状态,第一电离能最大的是N;O原子电负性最大;
(2)分析C、N成键情况,结合VSEPR模型判断;
(3)结合VSEPR模型判断;结合等电子体解答;
(4)NH3分子与水分子间形成氢键,增大氨的溶解性。
(5)①根据均摊法求解;②根据ρ=m/V计算。
(1)H、N、O、S、Ni、As中,因为N的价电子排布式为2s22p3,处于半充满状态,第一电离能最大的是N;O原子电负性最大,其价电子轨道表示式为![]() 。
。
(2)CH3NO2中C原子最外层的4个电子全部参与成键,VSEPR模型为正四面体,所以采取sp3杂化;N原子最外层的5个电子,形成3个σ键,还有1个π键,VSEPR模型为平面三角形,所以采取sp2杂化。C和N的原子轨道杂化方式分别为sp3 、sp2。
(3)SO32-中S上的孤电子对数为(6+2-2×3)/2=1,σ键数为3,价层电子对数=1+3=4,采用sp3杂化,其空间构型为三角锥形。与SO32-原子数相同,价电子总数相同的粒子可能为:AsO33-、ClO3- 、PCl3等之一。
(4)NH3极易溶于水其原因,除二者都为极性分子外,另一个重要原因是NH3分子与水分子间形成氢键。
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。
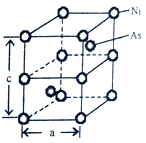
①Ni:8×1/8+4×1/4=2,As:2,化学式为NiAs;As原子的配位数为6;
②已知晶胞参数a=360.2pm,c=500.9pm,V=![]() ,此晶体的密度为ρ=m/V=
,此晶体的密度为ρ=m/V=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入4molA和2molB发生反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB
D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分:

(1)通常状况下,NO2的颜色是__________;
(2)反应①的化学方程式是________________________________;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是_________;
(4)化合物A的化学式是_______________;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 如下图所示,50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在装置中进行中和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
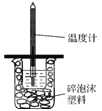
(1)图中装置缺少的仪器是 _______________。
(2)下列说法不正确的是________________ (填序号)。
A.若用50mL 0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL 0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B.用标准溶液润洗滴定管2-3次;
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
E.调节液面至0或0刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___________________.
(2)实验中眼睛注视_____________,直至滴定终点。判断到达终点的现象是___________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL,则c(HCl)=______。
(4)下列操作中,可能造成测定结果偏高的是________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。能判断该反应已经达到化学平衡的是( )
①v(NH3)正=2v(CO2)逆 ②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中混合气体的平均相对分子质量不变 ⑤密闭容器混合气体的总物质的量不变⑥密闭容器中CO2的体积分数不变 ⑦ 混合气体总质量
A. ①②③⑤⑦ B. ①②⑤⑦ C. ①⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.同种分子构成的物质一定是纯净物
B.纯净物一定只含有一种元素
C.混合物肯定由两种或两种以上元素组成
D.含有氧元素的化合物一定是氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com