
【题目】下列叙述正确的是
A. 乙醇和汽油(从石油中提炼)都是可再生能源,应大力推广“乙醇汽油”
B. 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C. 氢能具有的优点是原料来源广、热值高、储存方便、制备工艺廉价易行
D. 氢能是一次能源(从自然界中以现成形式提供的能源为一次能源)
科目:高中化学 来源: 题型:
【题目】下列操作对应的现象不符合事实的是
|
|
|
|
A.将二氧化碳气体通入CaCl2溶液,不会产生白色沉淀 | B.用激光笔照射Fe(OH)3胶体,产生“丁达尔效应” | C.将湿润的有色布条放入盛有干燥氯气的瓶中,布条不褪色 | D.将滴管中的浓盐酸加入碳酸氢钠溶液,气球体积由小变大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O==Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是
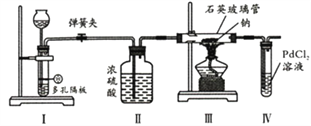
A. I中发生反应可以是Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
B. II中浓硫酸的目的是干燥CO2
C. 实验时,III中石英玻璃管容易受到腐蚀
D. 步骤IV的目的是证明还原产物是否有CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
A.FeC13 B.Ca(HCO3)2 C.Na[Al (OH)4] D.Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
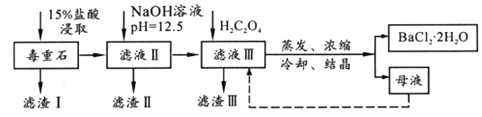
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为同主族相邻周期的元素,原子序数A>B,其中元素A位于第六周期,其原子序数为m,若为第ⅡA族,则B原子序数为 , 若为第 VIA族,则B原子序数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学键的说法正确的是( )
A.全部由非金属元素构成的化合物一定是共价化合物
B.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键
C.金属与非金属原子间只能形成离子键
D.含有共价键的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
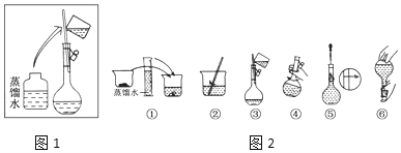
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com