
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
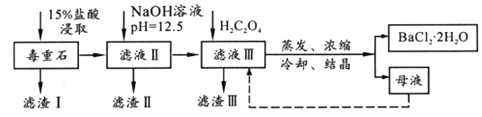
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。
【答案】 SiO2、BaSO4 玻璃棒、烧杯、漏斗 1.0×10-8mol/L 防止生成BaC2O4 Na+ 不可行 母液中的NaCl浓度会越来越大,最终产品纯度降低 CaC2O4·H2O 2CaC2O4+O2 ![]() 2CaCO3+2CO2
2CaCO3+2CO2
【解析】毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)加入盐酸溶解,生成氯化钙、氯化镁、氯化钡和氯化铁,且少量硫酸根与钡离子反应生成硫酸钡,滤渣Ⅰ为SiO2、BaSO4;加入氢氧化钠调节pH=12.5,铁离子、镁离子转化为氢氧化镁、氢氧化铁沉淀进入滤渣Ⅱ,滤液为氯化钡和氯化钙,加入草酸反应生成草酸钙沉淀,即滤渣Ⅲ为草酸钙;滤液Ⅲ蒸发浓缩、冷却结晶得到氯化钡晶体。(1)滤渣I的成分为SiO2、BaSO4,过滤所需玻璃仪器有玻璃棒、烧杯、漏斗;(2)镁离子完全沉淀的pH=11,则Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=10-5![]() (10-3)2=1.0×10-11,当pH=12.5时,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)
(10-3)2=1.0×10-11,当pH=12.5时,c(OH-)=10-1.5mol/L,Ksp[Mg(OH)2] =c(Mg2+)c2(OH-)=c(Mg2+)![]() (10-1.5)2=1.0×10-11,加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为1.0×10-8mol/L;加入H2C2O4时应避免过量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,过程中加入氢氧化钠,故还含有大量的Na+。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,在实际工业生产中不可行,因为母液中的NaCl浓度会越来越大,最终产品纯度降低;(4)根据上面分析可知,滤渣III的成分是CaC2O4·H2O;根据CaC2O4和CaCO3的相对分子质量分别为146、100,200~470℃时发生反应生成物为碳酸钙和二氧化碳,反应的化学方程式为2CaC2O4+O2
(10-1.5)2=1.0×10-11,加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为1.0×10-8mol/L;加入H2C2O4时应避免过量,其原因是防止生成BaC2O4 ;(3)BaCl2母液中除了含有Ba+、Cl-外,过程中加入氢氧化钠,故还含有大量的Na+。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,在实际工业生产中不可行,因为母液中的NaCl浓度会越来越大,最终产品纯度降低;(4)根据上面分析可知,滤渣III的成分是CaC2O4·H2O;根据CaC2O4和CaCO3的相对分子质量分别为146、100,200~470℃时发生反应生成物为碳酸钙和二氧化碳,反应的化学方程式为2CaC2O4+O2 ![]() 2CaCO3+2CO2。
2CaCO3+2CO2。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】研究性学习小组在辛集中学的玫瑰园与辛中公园附近分别采集一份土壤,分别配制成体积相同的两份营养液,其中两份各成分的含量如下:
含量 成分 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
① | 0.3mol | 0.2mol | 0.1mol | ﹣ |
② | 0.1mol | 0.3mol | ﹣ | 0.1mol |
两份营养液的成分
A. 完全不同 B. 完全相同
C. 只有n(K+)相同 D. 只有 n(Cl﹣)相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,具有致癌性。酸性KMnO4溶液与NaNO2反应的化学方程式为:MnO4+NO2+□→ Mn2++NO3+H2O(未配平)。下列叙述中正确的是
A. 该反应中NO2被还原 B. 生成1 mol NaNO3需消耗0.4 mol KMnO4
C. 反应过程中溶液的酸性增强 D. □中的粒子是OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙醇和汽油(从石油中提炼)都是可再生能源,应大力推广“乙醇汽油”
B. 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C. 氢能具有的优点是原料来源广、热值高、储存方便、制备工艺廉价易行
D. 氢能是一次能源(从自然界中以现成形式提供的能源为一次能源)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应:K2Cr2O7 + 14HCl=2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,用“单线桥”表示电子转移的方向和数目,并指出氧化产物和还原产物_____________ 。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5 mol,求被氧化的NH3在标准状况下的体积_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于sp3杂化轨道说法正确的是( )
A. 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是四面体
B. ![]() 分子中的
分子中的![]() 杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C. 金刚石是三维网状结构,由碳原子从sp3杂化轨道形成共价键
D. NH3和BF3分子中,中心原子均采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com