
【题目】关于下列晶体质的熔沸点高低排列判断不正确的是![]()
A. ![]()
B. 金刚石![]() 碳化硅
碳化硅![]() 晶体硅
晶体硅
C. H2O>H2S>H2Se>H2Te
D. ![]()
【答案】C
【解析】A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,故A正确;B.原子晶体的键长越短,共价键越强,熔沸点越高,键长C-C<C-Si<Si-Si,则熔沸点由大到小为金刚石>碳化硅>晶体硅,故B正确;C.水分子间能够形成氢键,其余不能,分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为H2O> H2Te >H2Se> H2S,故C错误;D.离子半径越小、离子键越强,则晶格能越大,熔沸点越高,F、Cl、Br、I的离子半径在增大,则熔沸点由大到小:NaF>NaCl>NaBr>NaI,故D正确;故选C。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(CO32-)更接近于0.lmol/L,可以采取的措施是( )
A.加入少量盐酸 B.加入适量的水 C.加入适量的KOH D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
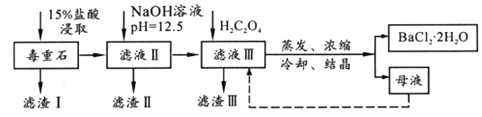
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 是一种淡黄色的油状液体
是一种淡黄色的油状液体![]() 下列对
下列对![]() 的有关叙述正确的是
的有关叙述正确的是![]()
A. ![]() 分子是由极性键构成的非极性分子
分子是由极性键构成的非极性分子
B. ![]() 分子的空间构型为平面三角形
分子的空间构型为平面三角形
C. NF3分子的稳定性较NCl3强
D. ![]() 的沸点比
的沸点比![]() 的沸点低是因为
的沸点低是因为![]() 比
比![]() 键键能小
键键能小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学键的说法正确的是( )
A.全部由非金属元素构成的化合物一定是共价化合物
B.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键
C.金属与非金属原子间只能形成离子键
D.含有共价键的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有下列各组反应,放出H2的平均速率最快的是(不考虑酸根对速率的影响)( )。
编号 | 金属 | 酸的浓度及体积 | 反应温度/℃ |
A | 2.4 g镁条 | 3 mol·L-1硫酸100 mL | 30 |
B | 2.4 g镁粉 | 3 mol·L-1盐酸200 mL | 40 |
C | 2.4 g镁粉 | 3 mol·L-1硫酸100 mL | 40 |
D | 5.6 g铁粉 | 3 mol·L-1硫酸100 mL | 40 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物的说法中正确的是![]()
![]() C3H8和C5H12的关系一定是同系物
C3H8和C5H12的关系一定是同系物
![]() 分子组成相差一个或几个
分子组成相差一个或几个![]() 原子团的有机物是同系物
原子团的有机物是同系物
![]() 若烃中碳、氢元素的质量分数相同,它们不一定是同系物
若烃中碳、氢元素的质量分数相同,它们不一定是同系物
![]() 同系物的化学性质相似,同分异构体的化学性质一定不相似
同系物的化学性质相似,同分异构体的化学性质一定不相似
![]() 乙烯和聚乙烯互为同系物
乙烯和聚乙烯互为同系物
⑥![]() 与
与![]() 互为同系物
互为同系物
A. ②⑥ B. ③⑤ C. ①③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以溴乙烷为原料,用下述六种反应的类型:(1)氧化(2)消去(3)加成(4)酯化(5)水解(6)加聚来合成乙二酸乙二酯的正确顺序
A. (1)(5)(2)(3)(4) B. (1)(2)(3)(4)(5)
C. (2)(3)(5)(1)(4) D. (2)(3)(5)(1)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
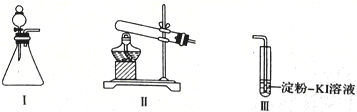
供选试剂:30%H2O2溶液、O.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向Ⅲ的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com