
【题目】(1)已知反应:K2Cr2O7 + 14HCl=2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,用“单线桥”表示电子转移的方向和数目,并指出氧化产物和还原产物_____________ 。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5 mol,求被氧化的NH3在标准状况下的体积_________________。
【答案】 ,氧化产物:Cl2 还原产物:CrCl3 22.4L
,氧化产物:Cl2 还原产物:CrCl3 22.4L
【解析】
(1)反应中Cr元素化合价降低,被还原,K2Cr2O7具有氧化性,Cl元素化合价升高,被氧化,HCl具有还原性,氧化还原反应中氧化剂和还原剂之间得失电子的数目相等,据此分析解答;
(2)被氧化的氨气生成氮气,根据反应的氯气结合方程式可以计算生成氮气的物质的量,再根据氮原子守恒计算被氧化的氨气的物质的量,进而计算被氧化氨气的体积。
(1)反应中Cr元素化合价降低,被还原,K2Cr2O7具有氧化性,为氧化剂,元素化合价由+6价降低为+3价,化合价变化3价,用单线桥法标出电子转移的方向和数目可表示为: ,化合价降低元素Cr对应的产物CrCl3是还原产物,化合价升高元素Cl对应的产物Cl2是氧化产物,故答案为:
,化合价降低元素Cr对应的产物CrCl3是还原产物,化合价升高元素Cl对应的产物Cl2是氧化产物,故答案为: ,氧化产物为Cl2,还原产物为CrCl3;
,氧化产物为Cl2,还原产物为CrCl3;
(2)被氧化的氨气生成氮气,根据方程式可知,消耗Cl2 1.5 mol会生成氨气的物质的量为1.5mol×![]() =0.5mol,根据氮原子守恒可知被氧化的氨气的物质的量为0.5mol×2=1mol,故被氧化氨气的体积为1mol×22.4L/mol=22.4L,故答案为: 22.4L。
=0.5mol,根据氮原子守恒可知被氧化的氨气的物质的量为0.5mol×2=1mol,故被氧化氨气的体积为1mol×22.4L/mol=22.4L,故答案为: 22.4L。


科目:高中化学 来源: 题型:
【题目】下列离子反应方程式,书写正确的是
A. 碳酸钠溶液中加入盐酸 CO32-+2H+=H2O+CO2↑
B. 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑
C. 碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑
D. 氢氧化钡溶液中加入硫酸 H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
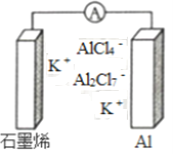
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.ⅠA族元素单质的熔点从上往下逐渐降低
B.分子晶体中一定存在共价键
C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D.同周期非金属氧化物对应的水化物的酸性从左往右依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:
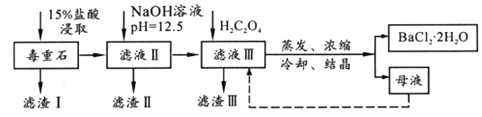
已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为________(填化学式),过滤所需玻璃仪器有______________。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____;加入H2C2O4时应避免过量,其原因是__________________________________。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______(填“可行”或“不可行”),理由是_______________________。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
溫度(℃) | 常温 | 190200 | 470480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是__________(填化学式);200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已发现了116号元素则下列推断正确的是:![]() 其钙盐的化学式为CaR;
其钙盐的化学式为CaR;![]() 其最高价氧化物对应的水化物的酸性比硫酸弱;
其最高价氧化物对应的水化物的酸性比硫酸弱;![]() 是金属元素;
是金属元素;![]() 是非金属元素;
是非金属元素;![]() 最外电子层有6个电子
最外电子层有6个电子![]()
A. ①②③ B. ①③⑤ C. ②④⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 是一种淡黄色的油状液体
是一种淡黄色的油状液体![]() 下列对
下列对![]() 的有关叙述正确的是
的有关叙述正确的是![]()
A. ![]() 分子是由极性键构成的非极性分子
分子是由极性键构成的非极性分子
B. ![]() 分子的空间构型为平面三角形
分子的空间构型为平面三角形
C. NF3分子的稳定性较NCl3强
D. ![]() 的沸点比
的沸点比![]() 的沸点低是因为
的沸点低是因为![]() 比
比![]() 键键能小
键键能小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有下列各组反应,放出H2的平均速率最快的是(不考虑酸根对速率的影响)( )。
编号 | 金属 | 酸的浓度及体积 | 反应温度/℃ |
A | 2.4 g镁条 | 3 mol·L-1硫酸100 mL | 30 |
B | 2.4 g镁粉 | 3 mol·L-1盐酸200 mL | 40 |
C | 2.4 g镁粉 | 3 mol·L-1硫酸100 mL | 40 |
D | 5.6 g铁粉 | 3 mol·L-1硫酸100 mL | 40 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

回答下列问题:
(1)检验滤液中的SO42-的方法是_______________________________________。
(2)试剂I的化学式为__________,加入过量试剂I后,①对应的实验操作是____,①中发生反应的离子方程式为___________________ 、__________________。
(3)试剂II的化学式为_________,②中加入过量试剂II的目的是_______________。
(4)试剂III的名称是________,操作③为__________、冷却结晶、过滤、洗涤、干燥,得到KCl晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com