
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

回答下列问题:
(1)检验滤液中的SO42-的方法是_______________________________________。
(2)试剂I的化学式为__________,加入过量试剂I后,①对应的实验操作是____,①中发生反应的离子方程式为___________________ 、__________________。
(3)试剂II的化学式为_________,②中加入过量试剂II的目的是_______________。
(4)试剂III的名称是________,操作③为__________、冷却结晶、过滤、洗涤、干燥,得到KCl晶体。
【答案】取少量滤液于试管中,先向其中加入盐酸酸化,再加入BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无; BaCl2; 过滤 Ba2++SO42-=BaSO4↓ Ba2++CO32-=BaCO3↓ K2CO3 除去多余的Ba2+ 盐酸 蒸发浓缩
【解析】
(1)首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-;
(2)用氯化钡溶液,能同时除去硫酸根离子和碳酸根离子,根据离子方程式的书写规则书写;
(3)为除去过量的钡离子选用K2CO3作试剂,不仅能除去钡离子同时还生成氯化钾;
(4)试剂Ⅲ的名称是盐酸,操作③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到KCl晶体。
(1)首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,反之则无,故答案为:取少量滤液于试管中,先向其中加入盐酸酸化,再加入BaCl2溶液,若有白色沉淀生成,则有SO42-,反之则无;
(2)要除掉杂质离子硫酸根和碳酸根,应加入过量的氯化钡溶液,碳酸根和硫酸根生成不溶于水的钡盐,同时生成氯化钾,离子方程式为:SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓,
故答案为:BaCl2;过滤;Ba2++SO42-=BaSO4↓,Ba2++CO32-=BaCO3↓;
(3)要除掉多余的钡离子,要加入碳酸钾,碳酸钾和氯化钡反应生成碳酸钡沉淀同时生成氯化钾,离子方程式为CO32-+Ba2+=BaCO3↓,
故答案为:K2CO3;除去多余的Ba2+;
(4)要除掉多余的碳酸根,要滴加适量的盐酸,碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为CO32-+2H+=CO2↑+H2O,操作③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到KCl晶体。故答案为:盐酸;蒸发浓缩;


科目:高中化学 来源: 题型:
【题目】(1)已知反应:K2Cr2O7 + 14HCl=2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,用“单线桥”表示电子转移的方向和数目,并指出氧化产物和还原产物_____________ 。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5 mol,求被氧化的NH3在标准状况下的体积_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率受很多因素影响。下列措施主要是从降低反应速率的角度考虑的是( )
A.将CaCO3固体研磨后再与稀HCl反应B.将FeCl3加入H2O2溶液中制备O2
C.将洗衣粉溶于温水后洗涤衣服D.将食物置于冰箱中冷藏保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应 SiO2(s)+C(s)+N2(g)![]() Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
A. 该反应的氧化剂为N2,还原产物为CO
B. 增加焦炭的用量,生成氮化硅的反应速率增大
C. 反应中每生成0.1 mol Si3N4转移的电子为1.2 mol
D. 反应的平衡常数可表示为K=c(CO)/c(N2),升高温度K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识不正确的是( )
A.电解水生成氢气和氧气时,电能转化为化学能
B.白炽灯工作时,电能全部转化为光能
C.煤燃烧时,化学能主要转化为热能
D.绿色植物的光合作用时,将光能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海洋资源的利用具有广阔前景。
Ⅰ.粗盐提纯
(1)从海水中得到的粗盐常含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④用适量盐酸调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___________________________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)判断Mg2+已沉淀完全的方法是:__________________________________________。
II.海带提碘
将海带灼烧成灰,用水浸泡得到海带灰悬浊液,过滤得含I-的海带浸取原液,然后按以下甲、乙两方案提取单质碘:
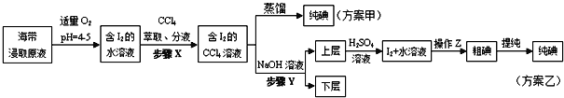
已知:3I2+6OH - ═5I- + IO3-+3H2O;5I-+IO3-+6H+=3I2 +3H2O;酸性条件下,I2在水溶液中的溶解度很小。
(3)分液漏斗使用前须_________;步骤X中,萃取后分液漏斗内观察到的现象是__________。
(4)下列有关步骤Y的说法,正确的是_____________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除浸取原液中的杂质 D.NaOH溶液可由乙醇代替
(5)步骤Y和操作Z的名称分别是___________、 _____________。
(6)方案甲中采用蒸馏不合理,理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com