
【题目】若已发现了116号元素则下列推断正确的是:![]() 其钙盐的化学式为CaR;
其钙盐的化学式为CaR;![]() 其最高价氧化物对应的水化物的酸性比硫酸弱;
其最高价氧化物对应的水化物的酸性比硫酸弱;![]() 是金属元素;
是金属元素;![]() 是非金属元素;
是非金属元素;![]() 最外电子层有6个电子
最外电子层有6个电子![]()
A. ①②③ B. ①③⑤ C. ②④⑤ D. ②③⑤
科目:高中化学 来源: 题型:
【题目】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: _____________。
(2)明矾净水的原理为(用离子方程式表示)____________________________。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________。
(4) 现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2. 80 g部分被氧化成氧化镁的镁条完全溶于50. 0 mL硫酸溶液后,滴加2. 00 mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去200. 0 mL。将所得的沉淀灼烧、冷却后称量得固体质量为4. 40 g。
请计算:
(1)质量为4. 40 g的固体是____________(填化学式)。
(2)镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=____________。
(3)在与50. 0 mL硫酸溶液反应前被氧化的镁的质量是_____________g。
(4)上述硫酸的物质的量浓度c(H2SO4)=_____________mol·Lˉ1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4的摩尔质量为_______________;
(2)8 g CH4中约含有______________个分子,含有电子物质的量为_________,在标准状况下所占的体积约为_______________;
(3)所含原子数相等的甲烷和氨(NH3)的质量比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应:K2Cr2O7 + 14HCl=2KCl + 2CrCl3 + 3Cl2↑+ 7H2O,用“单线桥”表示电子转移的方向和数目,并指出氧化产物和还原产物_____________ 。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5 mol,求被氧化的NH3在标准状况下的体积_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用密度为1.84g/cm3、质量分数为 98%的浓硫酸配制500mL0.22 mol/L的稀硫酸。
(1)操作过程中使用到的玻璃仪器有_____________________________________________________;
(2)实验过程中涉及的操作如下:
①将容量瓶中的溶液倒入试剂瓶中并贴上标签;
②将浓硫酸沿烧杯内壁缓慢注入盛有约160mL蒸馏水的烧杯中并小心搅拌;
③用规格为 的量筒量取 mL的浓硫酸;
④将已冷却的硫酸溶液转移到容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液全部转移到容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;
⑥塞好玻璃塞,反复颠倒摇匀;
⑦继续向容量瓶中加蒸馏水直到距离刻度线 处;
将步骤③、⑦补充完整:_____________,_____________,_______________;
实验操作顺序为__________________________________________(填序号)。
(3)配制该溶液的过程中,下列操作使得所配得的溶液浓度偏小的是______________(填字母) 。
A.稀释密度为1.84g/cm3、质量分数为 98%的浓硫酸时,不小心溅出少量硫酸溶液
B.用蒸馏水洗涤烧杯、量筒及玻璃棒,并将洗涤液注入容量瓶中
C.定容时反复上下倒转容量瓶后,发现凹液面最低处低于刻度线,再补加水到刻度线
D.量取密度为1.84g/cm3、质量分数为 98%的浓硫酸时,仰视量筒的刻度线
E.洗涤容量瓶后,立即用来配制溶液
F.稀释浓硫酸结束后立即将溶液转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有300mL MgCl2溶液,密度为1.18g/cm3,其中Mg2+的质量分数为5.1%。
(1)求该溶液中氯离子的物质的量。(结果保留1位小数)_______________
(2)向其中加入200mL 5mol/L NaOH溶液,充分反应后,求溶液中Mg2+的物质的量浓度_______________。(溶液混合过程中体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol/L、体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH与lg(V/V0)的变化关系如图所示。下列说法正确的是
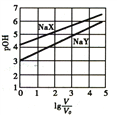
A. Kh(NaY)=10-6
B. HX、HY都是弱酸,且Ka(HX)<Ka(HY)
C. lg(V/V0)=3时,NaX溶液中所含离子总数大于NaY溶液
D. 向稀释前的两溶液中分别加盐酸至pH=7时,c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应 SiO2(s)+C(s)+N2(g)![]() Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
A. 该反应的氧化剂为N2,还原产物为CO
B. 增加焦炭的用量,生成氮化硅的反应速率增大
C. 反应中每生成0.1 mol Si3N4转移的电子为1.2 mol
D. 反应的平衡常数可表示为K=c(CO)/c(N2),升高温度K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com