
【题目】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: _____________。
(2)明矾净水的原理为(用离子方程式表示)____________________________。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________。
(4) 现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______。
【答案】 CH3COOH![]() H++CH3COO﹣ Al3++3H2O
H++CH3COO﹣ Al3++3H2O![]() Al(OH)3(胶体)+3H+ 4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ·mol-1 ①②③ ad 2∶9
Al(OH)3(胶体)+3H+ 4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ·mol-1 ①②③ ad 2∶9
【解析】(1)醋酸是弱酸,电离是可逆过程,电离方程式为CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;
(2)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+,故答案为:Al3++3H2OAl(OH)3(胶体)+3H+;
(3) 56g金属铁的物质的量为1mol,与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,反应的热化学方程式为4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-117 kJ/mol ×4=-468 kJ/mol,故答案为:4Fe(s)+3CO2(g) = 2Fe2O3(s)+3C(s) ΔH=-468 kJ/mol;
(4)碳酸氢钠是酸式盐,碳酸钠是正盐,所以碳酸钠的pH值大于碳酸氢钠的pH,氢氧化钠是强碱,完全电离,碱性最强,pH最大,三种溶液的pH由小到大的顺序为①②③,故答案为:①②③;
(5)a.某溶液的pH=9,说明溶液中存在NaA的水解过程,能够说明HA是弱电解质,正确;b.用HA溶液做导电实验,灯泡很暗,可能是HA的浓度很小的结果,不能说明HA是弱电解质,错误;c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多是因为硫酸是二元酸,HA为一元酸,与酸的强弱无关,错误;d.0.1mol/LHA溶液的pH≈2.8,说明HA未完全电离,能够说明HA是弱电解质,正确;故选ad;
(6)在100℃时,水的离子积为1×10-12,此温度下将pH=11的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液c(H+)=0.01mol/L,若所得混合溶液的pH=10,则反应后的溶液的c(OH-)=![]() mol/L=0.01mol/L,则c(OH-)=
mol/L=0.01mol/L,则c(OH-)=![]() =0.01mol/L,解得:V1:V2=2:9,故答案为:2:9。
=0.01mol/L,解得:V1:V2=2:9,故答案为:2:9。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
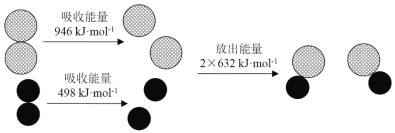
A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用装置中a、b均为多孔石墨电极。下列说法正确的是

A. b为电池的负极,发生还原反应
B. 电子流向:a电极→溶液→b电极
C. 一段时间后,b极附近HNO3浓度增大
D. a极的电极反应为NO2+e-+H2O=NO3-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应: 2SO2(g)+O2(g) ![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
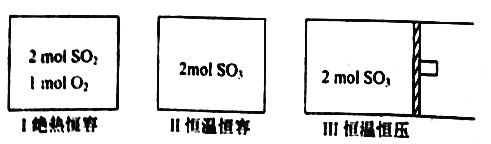
A. 达平衡时,容器I、II的总压强相等
B. 达平衡时,容器II中c(O2)/c(SO3)比容器I中的大
C. 达平衡时,容器Ⅱ中SO3的体积分数比容器III中的大
D. 达平衡时,容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式,书写正确的是
A. 碳酸钠溶液中加入盐酸 CO32-+2H+=H2O+CO2↑
B. 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑
C. 碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑
D. 氢氧化钡溶液中加入硫酸 H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙两名同学进行制备实验:
①甲同学的操作是:取一小烧杯,加入25ml蒸馏水加热至沸腾,向沸水中逐滴加入1~2mlFeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确__________。(填“正确”或“不正确”,下同)
②乙向沸水中滴加饱和FeCl3溶液,为了使反应充分进行,煮沸10分钟,请评价是否正确__________。
(2)写出制备Fe(OH)3胶体的化学方程式:_________________________________。
(3)聪明的你还想出来许多在家里观察丁达尔效应的方法,请设计一个你认为最简单、最环保的办法:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是
选项 | 性质 | 用途 |
A | 次氯酸有强氧化性 | 用作漂白剂 |
B | 氧化铝熔点很高 | 制造耐火坩埚 |
C | 硅有导电性 | 制造光导纤维 |
D | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已发现了116号元素则下列推断正确的是:![]() 其钙盐的化学式为CaR;
其钙盐的化学式为CaR;![]() 其最高价氧化物对应的水化物的酸性比硫酸弱;
其最高价氧化物对应的水化物的酸性比硫酸弱;![]() 是金属元素;
是金属元素;![]() 是非金属元素;
是非金属元素;![]() 最外电子层有6个电子
最外电子层有6个电子![]()
A. ①②③ B. ①③⑤ C. ②④⑤ D. ②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com