
【题目】一定条件下存在反应: 2SO2(g)+O2(g) ![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
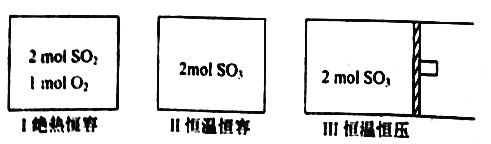
A. 达平衡时,容器I、II的总压强相等
B. 达平衡时,容器II中c(O2)/c(SO3)比容器I中的大
C. 达平衡时,容器Ⅱ中SO3的体积分数比容器III中的大
D. 达平衡时,容器I中SO2的转化率与容器II中SO3的转化率之和小于1
【答案】CD
【解析】A、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,容器I、II的总压强不相同,故A错误;B、容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,达平衡时,容器I中c(O2)/c(SO3)比容器II中的大,故B错误;C、容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,故C正确;D、若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故D正确;故选CD。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,属于同位素的是(填序号,下同)________,属于同素异形体的是________ ,互为同系物的是__________ ,属于同分异构体的是____________ ,属于同种物质的是____________。
A.O2和O3 B.![]()
![]()
![]()


(2)下面的键线式表示维生素A的分子结构:

① 该分子内含有__________个碳原子,_________个氢原子,_________个氧原子;维生素A中氧的质量分数是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
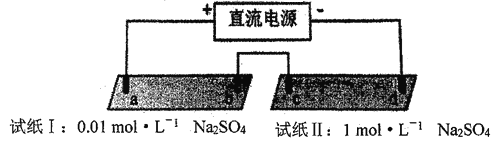
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y的原子序数都小于18,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
A.n+1B.n-5C.n+3D.n-6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+ 3O2(g)==2Cu2O(s)+2SO2(g) △H =-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+ SO2(g) △H =+116.0kJ·mol-1,
热化学方程式: Cu2S(s)+ O2(g)==2Cu(s)+2SO2(g) △H =______kJ·mol-1
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O==4CuH ↓+4H2SO4+3H3PO4。
①该反应还原剂是___________(写化学式)。
②该反应每转移6mol电子,生成CuH的物质的量为_____。
(3)采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示。
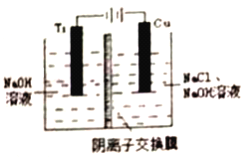
①该电池的阳极生成Cu2O反应式为___________________________。
②钛(Ti) 极附近的pH值_________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: _____________。
(2)明矾净水的原理为(用离子方程式表示)____________________________。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________。
(4) 现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4的摩尔质量为_______________;
(2)8 g CH4中约含有______________个分子,含有电子物质的量为_________,在标准状况下所占的体积约为_______________;
(3)所含原子数相等的甲烷和氨(NH3)的质量比为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com