
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+ 3O2(g)==2Cu2O(s)+2SO2(g) △H =-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+ SO2(g) △H =+116.0kJ·mol-1,
热化学方程式: Cu2S(s)+ O2(g)==2Cu(s)+2SO2(g) △H =______kJ·mol-1
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O==4CuH ↓+4H2SO4+3H3PO4。
①该反应还原剂是___________(写化学式)。
②该反应每转移6mol电子,生成CuH的物质的量为_____。
(3)采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示。
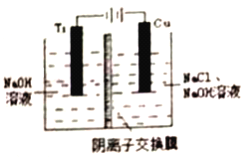
①该电池的阳极生成Cu2O反应式为___________________________。
②钛(Ti) 极附近的pH值_________(填“增大”、“减小”或“不变”)
【答案】 -217.4 H3PO2 2 mol 2Cu-2e-+2OH-=Cu2O+H2O 增大
【解析】(1)①2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJmol-1,②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJmol-1,据盖斯定律(①+②)×![]() 得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=-217.4kJ/mol,故答案为:-217.4;
得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=-217.4kJ/mol,故答案为:-217.4;
(2)①从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,H从+1价变成-1价,P从+1价变成+5价,还原剂化合价升高,故该反应的还原剂是H3PO2,故答案为:H3PO2;
②Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,即每生成4molCuH转移电子12mol,所以每转移6mol电子,生成CuH的物质的量为2mol,故答案为:2mol;
(3)①在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
②钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则pH值增大,故答案为:增大。


科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
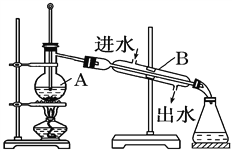
(1)指出图中两处明显的错误:
①____________________________,②____________________________。
(2)A仪器的名称是__________,B仪器的名称是__________。
(3)实验时A中除加入少量自来水外,还需加入少量__________,其作用是防止加热时液体____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
①、  此键线式所表示有机物的结构简式是:________________;
此键线式所表示有机物的结构简式是:________________;
②、 此有机物的系统命名为:________________;
此有机物的系统命名为:________________;
③、 ![]() 此有机物用系统命名法的名称是:________________;
此有机物用系统命名法的名称是:________________;
④、写出结构简式: 2,2-二甲基-3-乙基己烷________________;
⑤、写出结构简式: 2-甲基-2-丁烯________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家侯德榜创立了中国的制碱工艺,促进了世界制碱技术的发展。下图是纯碱工艺的简化流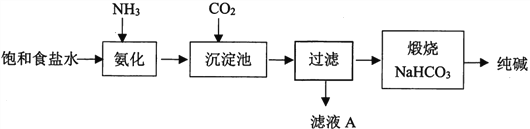
(1)写出CO2的电子式____________________。
(2)用离子方程式表示纯碱工艺中HCO3-的生成___________________。
(3)工业生产时先氨化再通CO2,顺序不能颠倒,原因是_______________。
(4)滤液A中最主要的两种离子是_________。
(5)某小组设计如下实验分离滤液A中的主要物质。打开分液漏斗活塞,一段时间后,试管中有白色晶体生成,用化学原理解释白色晶体产生的原因___________________。

(6)某纯碱样品因煅烧不充分而含少量NaHCO3,取质量为m1的纯碱样品,充分加热后质量为m2,则此样品中碳酸氢钠的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应: 2SO2(g)+O2(g) ![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
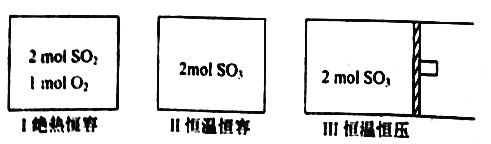
A. 达平衡时,容器I、II的总压强相等
B. 达平衡时,容器II中c(O2)/c(SO3)比容器I中的大
C. 达平衡时,容器Ⅱ中SO3的体积分数比容器III中的大
D. 达平衡时,容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙两名同学进行制备实验:
①甲同学的操作是:取一小烧杯,加入25ml蒸馏水加热至沸腾,向沸水中逐滴加入1~2mlFeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确__________。(填“正确”或“不正确”,下同)
②乙向沸水中滴加饱和FeCl3溶液,为了使反应充分进行,煮沸10分钟,请评价是否正确__________。
(2)写出制备Fe(OH)3胶体的化学方程式:_________________________________。
(3)聪明的你还想出来许多在家里观察丁达尔效应的方法,请设计一个你认为最简单、最环保的办法:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 常温下,(1) Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是

A. 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水大
C. 在pH=3的溶液中存在c(R2)×c(H2R)/c2(HR)=10-3
D. 向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为: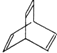
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:

已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com