
����Ŀ��I.�л���Ľṹ���á�����ʽ����ʾ��CH3-CH=CH-CH3�ɼ�дΪ![]() ���л���X�ļ���ʽΪ��
���л���X�ļ���ʽΪ��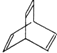
(1)�л���Y��X��ͬ���칹�壬�����ڷ�������д��Y�Ľṹ��ʽ_______________��
(2)Y��һ�������·����ۺϷ�Ӧ��д���䷴Ӧ�Ļ�ѧ����ʽ_______________________��
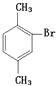
(3)���ױ������ϵ�һ�������6��ͬ���칹�壬��Щһ��������������ǵĶ�Ӧ���ױ����۵�ֱ�Ϊ��
һ������ױ� | 234�� | 206�� | 213.8�� | 204�� | 214.5�� | 205�� |
��Ӧ���ױ� | 13�� | -54�� | -27�� | -54�� | -27�� | -54�� |
�����������ƶϣ�
�۵�Ϊ234���һ������ױ��Ľṹ��ʽΪ____________���۵�Ϊ-27��Ķ��ױ�������Ϊ____________��
II.���Ƽ���H1N1���еij���ҩ���а�˾��Τ��������Τ������Ұ�������鰷�Լ�Ԥ��ҩ������ҩ�Ľ�����������Ҷ�ȡ����н���鰷�ɰ�����·�ߺϳɣ�

��֪�Ҷ�˹���¶���Ӧ(Ҳ��˫ϩ�ϳɷ�Ӧ)������ʾ��

�Իش��������⣺
(1)B�ĽṹʽΪ________________(�����ʽ)��
(2)����������,����ͬ���칹�����________(����ĸ)��
(3)������Ӧ��,���ڼӳɷ�Ӧ����________(������)��
���𰸡� ![]()

 �ڶ��ױ�
�ڶ��ױ� ![]() CD �٢�
CD �٢�
��������(1)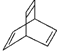 �ķ���ʽΪ
�ķ���ʽΪ![]() ,Y�к��б���,Y�Ľṹ��ʽ:
,Y�к��б���,Y�Ľṹ��ʽ:![]() ����ȷ��:
����ȷ��:![]() ��
��
(2)![]() �к���˫���ܷ����Ӿ۷�Ӧ:
�к���˫���ܷ����Ӿ۷�Ӧ: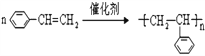 ����ȷ��:
����ȷ��: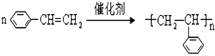 ��
��
(3)���ױ�������ͬ���칹��,�ֱ�Ϊ�Զ��ױ�������ױ����ڶ��ױ�.��һ�����ֱ���1�֡�3�ֺ�2�������ݱ��ж�Ӧ���ױ����۵���ж�,�۵�Ϊ![]() �Ķ��ױ�ֻ��һ��һ�����,�۵�Ϊ
�Ķ��ױ�ֻ��һ��һ�����,�۵�Ϊ![]() �Ķ��ױ���3��һ�����,���۵�Ϊ
�Ķ��ױ���3��һ�����,���۵�Ϊ![]() �Ķ��ױ���2��һ�����.����۵�Ϊ
�Ķ��ױ���2��һ�����.����۵�Ϊ![]() �Ķ��ױ��ǶԶ��ױ�,�۵�Ϊ
�Ķ��ױ��ǶԶ��ױ�,�۵�Ϊ![]() �Ķ��ױ��Ǽ���ױ�,�۵�Ϊ
�Ķ��ױ��Ǽ���ױ�,�۵�Ϊ![]() �Ķ��ױ����ڶ��ױ�.�۵�Ϊ
�Ķ��ױ����ڶ��ױ�.�۵�Ϊ![]() ��һ����ױ�����Ӧ�Ķ��ױ���
��һ����ױ�����Ӧ�Ķ��ױ���![]() �Ķ��ױ�����������������֪��,�۵�Ϊ
�Ķ��ױ�����������������֪��,�۵�Ϊ![]() ��һ������ױ���Ӧ�����۵�Ϊ
��һ������ױ���Ӧ�����۵�Ϊ![]() ���ױ�:�Զ��ױ�,�Զ��ױ������ϵ�һ�����Ľṹ��ʽΪ:
���ױ�:�Զ��ױ�,�Զ��ױ������ϵ�һ�����Ľṹ��ʽΪ: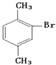 ���۵�Ϊ
���۵�Ϊ![]() �Ķ��ױ�Ϊ�ڶ��ױ�����ȷ��:
�Ķ��ױ�Ϊ�ڶ��ױ�����ȷ��: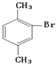 ���ڶ��ױ���
���ڶ��ױ���
II. ��1��������Ϣ�Ҷ�˹���¶���Ӧ��֪����Ӧ��Ϊ2����A����B����Ȼ�������Ǽӳɷ�Ӧ����B�ĽṹʽΪ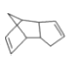 ����ȷ����
����ȷ���� ��
��
��2��ͬ���칹��ָ���Ƿ���ʽ��ͬ���ṹ��ͬ���л�������������ʵĽṹ��ʽ������C��D�����л������ʽ��ΪC10H16�����ǽṹ��ͬ����Ȼ��Ϊͬ���칹�壻��ȷ�𰸣�CD��
��3�������������̹��̷�����֪��ֻ���٢����ڼӳɷ�Ӧ���ۢܢ�����ȡ����Ӧ����ȷ�����٢ڡ�


 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ũҵ�������ճ�������Ӧ�÷dz��㷺��
(1) �ɻ�ͭ����ȡͭ�ķ�Ӧ����Ϊ:
2Cu2S(s)+ 3O2(g)==2Cu2O(s)+2SO2(g) ��H =-768.2kJ��mol-1��
2Cu2O(s)+Cu2S(s)=6Cu(s)+ SO2(g) ��H =+116.0kJ��mol-1��
�Ȼ�ѧ����ʽ: Cu2S(s)+ O2(g)==2Cu(s)+2SO2(g) ��H =______kJ��mol-1
(2) �⻯��ͭ��һ�ֺ�ɫ���壬�������з�Ӧ�Ʊ�:4CuSO4+3H3PO2+6H2O==4CuH ��+4H2SO4+3H3PO4��
�ٸ÷�Ӧ��ԭ����___________(д��ѧʽ)��
�ڸ÷�Ӧÿת��6mol���ӣ�����CuH�����ʵ���Ϊ_____��
(3)�������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��
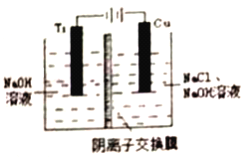
�ٸõ�ص���������Cu2O��ӦʽΪ___________________________��
����(Ti) ��������pHֵ_________(���������С�����䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д���������ʵĻ�ѧʽ��
������_______________��
��С�մ�________________��
��2��д��þ���ڶ�����̼������ȼ�յ���ѧ����ʽ__________________________________________��
��3��д��ʵ�������������ռ���Һ������������������ʽ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300mL Al2(SO4)3��Һ�У���Al3+Ϊ1.62g���ڸ���Һ�м���0.1mol��L��1Ba(OH)2��Һ300mL����Ӧ����Һ��SO42�������ʵ���Ũ��Ϊ( )
A. 0.4mol��L��1 B. 0.3mol��L��1 C. 0.2mol��L��1 D. 0.1mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)CH4��Ħ������Ϊ_______________��
(2)8 g CH4��Լ����______________�����ӣ����е������ʵ���Ϊ_________���ڱ�״������ռ�����ԼΪ_______________��
(3)����ԭ������ȵļ���Ͱ�(NH3)��������Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ����ķ�ɢϵ���ش��������⡣
(1)��������ڵ�����ˮ����μ���___________��Һ�����������________________________________��ֹͣ���ȣ����Ƶ�Fe(OH)3���壻
(2)��Fe(OH)3�����еμ������(HIˮ��Һ)���������۲쵽������Ϊ________________________________________���÷�Ӧ�����ӷ���ʽΪ________________________________________________________��
(3)����ͼ��ʾ��ͨ���Fe(OH)3����������_________�缫�ƶ�(����X������Y��)��
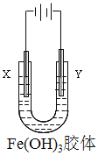
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ��������500mL0.22 mol/L��ϡ���ᡣ
(1)����������ʹ�õ��IJ���������_____________________________________________________��
(2)ʵ��������漰�IJ������£�
�ٽ�����ƿ�е���Һ�����Լ�ƿ�в����ϱ�ǩ��
�ڽ�Ũ�������ձ��ڱڻ���ע��ʢ��Լ160mL����ˮ���ձ��в�С�Ľ��裻
���ù��Ϊ ����Ͳ��ȡ mL��Ũ���
�ܽ�����ȴ��������Һת�Ƶ�����ƿ�У�������������ˮϴ���ձ��Ͳ�����2~3�Σ�ϴ��Һȫ��ת�Ƶ�����ƿ�У�����ҡ������ƿ��ʹ��Һ��Ͼ��ȣ�
�ݸ��ý�ͷ�ιܵμ�����ˮ��ʹ��Һ��Һ����ʹ�ǡ����̶������У�
�����ò������������ߵ�ҡ�ȣ�
����������ƿ�м�����ˮֱ������̶��� ����
����������߲���������_____________��_____________��_______________��
ʵ�����˳��Ϊ__________________________________________(�����)��
(3)���Ƹ���Һ�Ĺ����У����в���ʹ������õ���ҺŨ��ƫС����______________(����ĸ) ��
A��ϡ���ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ����ʱ����С�Ľ�������������Һ
B��������ˮϴ���ձ�����Ͳ��������������ϴ��Һע������ƿ��
C������ʱ�������µ�ת����ƿ���ְ�Һ����ʹ����ڿ̶��ߣ��ٲ���ˮ���̶���
D����ȡ�ܶ�Ϊ1.84g/cm3����������Ϊ 98%��Ũ����ʱ��������Ͳ�Ŀ̶���
E��ϴ������ƿ����������������Һ
F��ϡ��Ũ�����������������Һת�Ƶ�����ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У����۶������κα�����ϣ�ֻҪ������һ��������ȫȼ��ʱ����O2������������ˮ������������ǣ� ��
A��CH4��C2H6 B��C2H6��C3H6 C��C2H4��C3H6 D��C2H4��C3H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں������������������·�Һ��NH4+��ת��ΪN2(g)��H2O(l)��ʾ��ͼ���£�
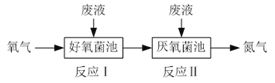
��ӦI��NH4+(aq)��2O2(g)=NO3��(aq)��2H+(aq)��H2O(l) ��H1��a kJ��mol��1
��ӦII��5NH4+(aq)��3NO3��(aq)=4N2(g)��9H2O(l)��2H+(aq) ��H2��b kJ��mol��1
����˵����ȷ����
A. ���ط����ķ�Ӧ�е�Ԫ��ֻ������
B. ������Ͷ�ŵķ�Һ������ʱNH4+����ȫת��ΪN2
C. ���³�ѹ�£���ӦII������22.4 L N2ת�Ƶĵ�����Ϊ3.75��6.02��1023
D. 4NH4+(aq)��3O2(g)=2N2(g)��4H+(aq)��6H2O(l) ��H��![]() (3a��b) kJ��mol��1
(3a��b) kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com