
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol·L-1Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量浓度为( )
A. 0.4mol·L-1 B. 0.3mol·L-1 C. 0.2mol·L-1 D. 0.1mol·L-1
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10﹣10 , Ksp (BaCO3)=2.6×10﹣9 . 该温度下,下列说法不正确的是( )
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中 ![]() =
= ![]()
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是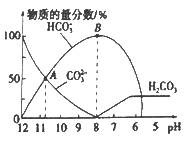
A.随着稀盐酸的加入,溶液中 ![]() 保持不变
保持不变
B.根据A点计算,Ka2 (H2CO3)的数量级为10-3
C.B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如右图所示,下列说法正确的是( ) ![]()
A.E元素的最高化合价为+7价时,D元素的负化合价可为﹣2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、SO32﹣、Cl﹣和Na+ , 若向其中通入足量的Cl2 , 溶液中上述四种离子的浓度基本保持不变的是( )
A.HCO3﹣
B.SO32﹣
C.Cl﹣
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如图:

请回答下列问题:
①酸雨的pH_____(填“>”、“<”或“=”)5.6;
②D物质的化学式为_____;
③反应b的化学方程式为_____;
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应生成氮气和水的化学方程式:____________________,反应中氧化剂是____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)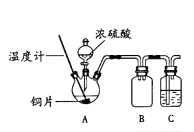
实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是;装置C中盛放的试剂是。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+ , 补充的实验操作及现象是。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com