
����Ŀ����ѧ�Һ�°������й����Ƽ�գ��ٽ��������Ƽ���ķ�չ����ͼ�Ǵ���յļ���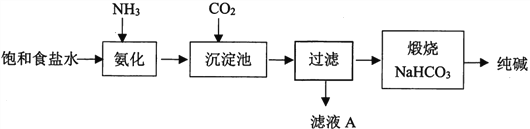
��1��д��CO2�ĵ���ʽ____________________��
��2�������ӷ���ʽ��ʾ�������HCO3-������___________________��
��3����ҵ����ʱ�Ȱ�����ͨCO2��˳���ܵߵ���ԭ����_______________��
��4����ҺA������Ҫ������������_________��
��5��ijС���������ʵ�������ҺA�е���Ҫ���ʡ���Һ©��������һ��ʱ����Թ����а�ɫ�������ɣ��û�ѧԭ�����Ͱ�ɫ���������ԭ��___________________��

��6��ij������Ʒ�����ղ���ֶ�������NaHCO3��ȡ����Ϊm1�Ĵ�����Ʒ����ּ��Ⱥ�����Ϊm2�������Ʒ��̼�����Ƶ���������Ϊ______________________��
���𰸡� ![]() CO2+NH3��H2O=HCO3��+NH4+ NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������� NH4+��Cl- ��ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s)
CO2+NH3��H2O=HCO3��+NH4+ NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������� NH4+��Cl- ��ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ����
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ![]()
����������1��CO2Ϊ���ۻ�������̼ԭ������ԭ�Ӽ��γ�˫����CO2�ĵ���ʽΪ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��2��������̼ͨ�백����ˮ��Һ����������Ӧ����̼����������ӷ���ʽΪ. CO2+NH3��H2O=HCO3��+NH4+ ����ȷ����CO2+NH3��H2O=HCO3��+NH4+��
��3��NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������������Թ�ҵ����ʱ�Ȱ�����ͨCO2����ȷ�𰸣�NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3�����������
��4��̼�������Һ���Ȼ�����Һ��Ϻ��������Ȼ�狀�̼�����������˺���ҺA����ҪΪ�Ȼ����Һ��������ҺA������Ҫ������������NH4+��Cl-����ȷ����NH4+��Cl-��
��5��Ũ��ˮ����ʯ�ҷ�Ӧ���ɰ������뵽�Ȼ�����Һ����ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ��������ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ʹƽ��NH4Cl(s)
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ��������ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ��������ȷ�𰸣���ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s)
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ��������ȷ�𰸣���ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ��
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ��
��6��![]() ���ɷ���ʽ��֪��2mol
���ɷ���ʽ��֪��2mol![]() ��Ӧ����Ӧǰ����������ͼ���
��Ӧ����Ӧǰ����������ͼ���![]() ����ô���з�Ӧǰ���������������m1-m2��g,��Ҫ
����ô���з�Ӧǰ���������������m1-m2��g,��Ҫ![]() ������Ϊx=84��m1-m2��/31, ���������ʽ�ɵã���(NaHCO3)= x/ m1��100%=
������Ϊx=84��m1-m2��/31, ���������ʽ�ɵã���(NaHCO3)= x/ m1��100%=![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʽ![]() ��ʾ�ķ���ʽ____________________��������________________________��
��ʾ�ķ���ʽ____________________��������________________________��
��2�� 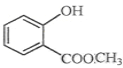 �к��еĹ����ŵ�����Ϊ_____________________________________��
�к��еĹ����ŵ�����Ϊ_____________________________________��
��3�����������ֽṹ��ʽΪ____________________��______________________��
��4��д�������л���Ľṹ��ʽ
2��2��3��3���ļ�����_____________________________
3��4��������4���һ�����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��W���ֶ���������Ԫ�أ�ԭ��������������Ԫ��������ԭ�ӣ���������ṹ���±���ʾ��
Ԫ�ر�� | Ԫ��������ԭ�ӣ���������ṹ |
X | ԭ�Ӻ���û������ |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Z | ���ڲ��������������2�� |
W | ������Ԫ����ԭ�Ӱ뾶��С |
��ش�
��1��д��Ԫ��Z�����ڱ��е�λ��______������Ԫ��W��ԭ�ӽṹʾ��ͼ______��
��2��Y��W��ȣ���̬�⻯���ȶ��Խ�������________���ѧʽ����ͬ������Ԫ������������Ӧˮ�������Ը�ǿ����__________��
��3��X��Y��Z����Ԫ�ؿ����γɻ�����ZYX2�����뻯����XW������Ӧ�����������Σ�д���÷�Ӧ�Ļ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ������飨C2H5Br���ķ���Ϊ��
NaBr �� H2SO4 �� NaHSO4 �� HBr
C2H5OH �� HBr ![]() C2H5Br �� H2O
C2H5Br �� H2O
���п��ܻᷢ������Ӧ:
2HBr �� H2SO4(Ũ) �� Br2 ���� SO2�� �� 2H2O
��ȡ��װ�úͲ�����ͼ����֪������ķе�38��4�棬������ˮ����
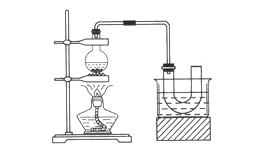
�ټ��װ�õ������ԣ���װ��ͼ��ʾ��U�ιܺʹ��ձ��м����ˮ��
����Բ����ƿ�м���10 mL 95���Ҵ���28 mL 78��Ũ���ᣬȻ�������ϸ��13g�廯�ƺͼ������Ƭ��
��С�ļ��ȣ�ʹ���ַ�Ӧ��
�������Ϣ�ش��������⣺
��1����Ӧʱ���¶ȹ��ߣ��ɿ����к���ɫ������������������ʽΪ___________��ͬʱ���ɵ���ɫ�������ʽΪ________________��
��2��Ϊ�˸��õĿ����¶ȣ�����ͼʾ��С������⣬���õļ��ȷ�ʽΪ________��
��3����Ӧ������U�ι��ڴ��Ƶ�C2H5Br���ػ�ɫ��Ϊ�˳�ȥ�ֲ�Ʒ�е����ʣ�����ѡ�������Լ��е�________________________������ţ���
A��NaOH��Һ B��H2O C��Na2SO3��Һ D��CCl4
Ҫ��һ���Ƶô�����C2H5Br������ˮϴ��Ȼ�������ˮCaCl2���ٽ���__________����������ƣ���
��4�����м���ʵ�鲽�裬Ϊ�˼�������������Ԫ�أ�ȡ�������������Ʒ��������ȷ�IJ���˳���ǣ�___________________������ţ���
�ټ��ȣ��ڼ���AgNO3��Һ���ۼ���ϡHNO3�ữ���ܼ���NaOHˮ��Һ������ȴ
A. �ܢ٢ݢۢ� B. �ܢۢ٢ݢ� C. �ܢۢڢ٢� D. �ܢڢ٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽���糡�������������ӵ�Ǩ�ơ�a��b��c��d ��Ϊʯī�缫���缫���4cm����pH��ֽ�ò�ͬŨ��Na2SO4��Һ�����ʪ����������ʵ�飺
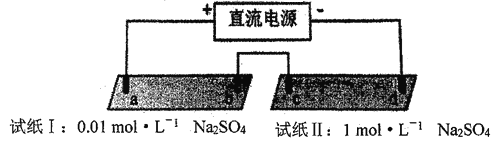
ʵ������
ʱ�� | ��ֽI | ��ֽII |
lmin | a��������ֽ��죬b��������ֽ���� | c��������ֽ��죬d���������� |
10min | ��ɫ������ɫ���������м���չ������ʱ��ɫ��Լ2.7cm����ɫ��Լ1.3cm | ������ɫ��Χ�������ԣ���ֽ����Ϊ��ɫ |
����˵������ȷ����
A. d��������ֽ����
B. a��������ֽ����ԭ���ǣ�2H2O+2e-= H2��+2OH-
C. �Ա���ֽI����ֽII������˵�������Ũ�Ȼ���Ӱ��H+��OH-��Ǩ��
D. ��ֽI������˵�����˻�����H+��Ǩ�����ʱ�OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��pH��11 ��NaOH ��Һ��pH��3 ��CH3COOH��Ҵ�������Ϻ����й�ϵʽ����ȷ����
A. c(Na+)==c(CH3COO��)+c(CH3COOH)
B. c(H+)==c(CH3COO��)+c(OHһ)
C. c(Na+) >c(CH3COO��)>c(OH��)>c(H+)
D. c (CH3COO��)>c(Na+)>c(H+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ũҵ�������ճ�������Ӧ�÷dz��㷺��
(1) �ɻ�ͭ����ȡͭ�ķ�Ӧ����Ϊ:
2Cu2S(s)+ 3O2(g)==2Cu2O(s)+2SO2(g) ��H =-768.2kJ��mol-1��
2Cu2O(s)+Cu2S(s)=6Cu(s)+ SO2(g) ��H =+116.0kJ��mol-1��
�Ȼ�ѧ����ʽ: Cu2S(s)+ O2(g)==2Cu(s)+2SO2(g) ��H =______kJ��mol-1
(2) �⻯��ͭ��һ�ֺ�ɫ���壬�������з�Ӧ�Ʊ�:4CuSO4+3H3PO2+6H2O==4CuH ��+4H2SO4+3H3PO4��
�ٸ÷�Ӧ��ԭ����___________(д��ѧʽ)��
�ڸ÷�Ӧÿת��6mol���ӣ�����CuH�����ʵ���Ϊ_____��
(3)�������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��
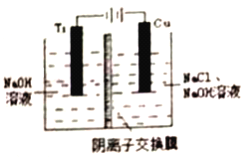
�ٸõ�ص���������Cu2O��ӦʽΪ___________________________��
����(Ti) ��������pHֵ_________(���������С�����䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LEDϵ�в�Ʒ��һ�����ͽ��ܲ�Ʒ��ͼ����NaBH4/H2O2ȼ�ϵ�أ�ͼ����LED��������ܵ�װ��ʾ��ͼ�����������������

A�����A�����ĵ缫��ӦʽΪ��H2O2+2e-=2OH-
B����طŵ�����У�Na+�Ӹ��������������ƶ�
C��ÿ��1mol NaBH4�μӷ�Ӧת�Ƶ�����Ϊ4NA
D��ҪʹLED����������������⣬ͼ���еĵ���aӦ��ͼ���е�B������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300mL Al2(SO4)3��Һ�У���Al3+Ϊ1.62g���ڸ���Һ�м���0.1mol��L��1Ba(OH)2��Һ300mL����Ӧ����Һ��SO42�������ʵ���Ũ��Ϊ( )
A. 0.4mol��L��1 B. 0.3mol��L��1 C. 0.2mol��L��1 D. 0.1mol��L��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com