
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
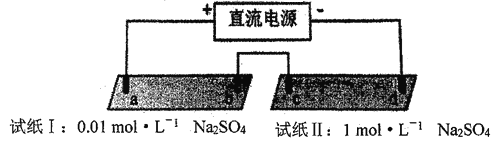
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物),冬季空气污染严重也跟冬季燃煤密切相关。
SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)PM2.5是指大气中直径小于或等于2.5微米的可入肺的有害颗粒,下列有关说法中正确的是______(填字母)。
a.PM2.5在空气中一定能形成气溶胶
b.PM2.5比表面积大能吸附大量的有毒有害物质
c.PM2.5 主要来源于直接排放的工业污染物和汽车尾气等
d.酸雨、臭氧层破坏等环境问题与PM2.5无关
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJmol-1
CH3OH(g)+H2O(g) △H=-a kJmol-1
2H2(g)+O2(g)=2H2O(g) △H=-b kJmol-1
H2O(g)-H2O(l) △H=-c kJmol-1
CH3OH(g)=CH3OH(l) △H=-d kJmol-1
则表示CH3OH(l)燃烧热的热化学方程式为________________________________。
(3)工业上还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
CH3OH(g)。在一容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图所示。
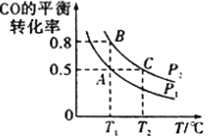
①下列说法不能判断该反应达到化学平衡状态的是______(填字母)。
a.H2的消耗速率是CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_____ PB (填“>”、“<”或“=”)。
③若达到化学平衡状态A时。容器的体积为20L。如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=____________L。
(4)SO2在一定条件下可与氧气构成原电池。右图是利用该电池在铁表面镀铜的装置示意图:
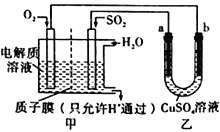
①该电池的负极反应:__________________________________;质于膜(只允许H通过)
②当甲中消耗2.24 LO2(标准状况)时,乙中__________(填“a”或“b”)增重_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2O2(l)![]() 2H2O(l)+O2(g)能量变化如图所示,下列说法正确的是
2H2O(l)+O2(g)能量变化如图所示,下列说法正确的是
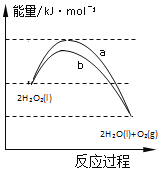
A. 由于分解反应,所以该反应吸热
B. 途径b改变了反应的热效应
C. 1 molH2O2(l)的能量高于1 molH2O(l)的能量
D. 途径a放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
①、  此键线式所表示有机物的结构简式是:________________;
此键线式所表示有机物的结构简式是:________________;
②、 此有机物的系统命名为:________________;
此有机物的系统命名为:________________;
③、 ![]() 此有机物用系统命名法的名称是:________________;
此有机物用系统命名法的名称是:________________;
④、写出结构简式: 2,2-二甲基-3-乙基己烷________________;
⑤、写出结构简式: 2-甲基-2-丁烯________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用装置中a、b均为多孔石墨电极。下列说法正确的是

A. b为电池的负极,发生还原反应
B. 电子流向:a电极→溶液→b电极
C. 一段时间后,b极附近HNO3浓度增大
D. a极的电极反应为NO2+e-+H2O=NO3-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家侯德榜创立了中国的制碱工艺,促进了世界制碱技术的发展。下图是纯碱工艺的简化流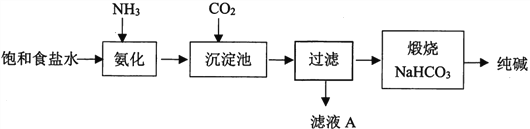
(1)写出CO2的电子式____________________。
(2)用离子方程式表示纯碱工艺中HCO3-的生成___________________。
(3)工业生产时先氨化再通CO2,顺序不能颠倒,原因是_______________。
(4)滤液A中最主要的两种离子是_________。
(5)某小组设计如下实验分离滤液A中的主要物质。打开分液漏斗活塞,一段时间后,试管中有白色晶体生成,用化学原理解释白色晶体产生的原因___________________。

(6)某纯碱样品因煅烧不充分而含少量NaHCO3,取质量为m1的纯碱样品,充分加热后质量为m2,则此样品中碳酸氢钠的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应: 2SO2(g)+O2(g) ![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
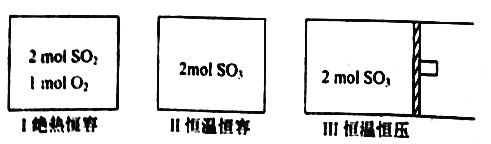
A. 达平衡时,容器I、II的总压强相等
B. 达平衡时,容器II中c(O2)/c(SO3)比容器I中的大
C. 达平衡时,容器Ⅱ中SO3的体积分数比容器III中的大
D. 达平衡时,容器I中SO2的转化率与容器II中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙两名同学进行制备实验:
①甲同学的操作是:取一小烧杯,加入25ml蒸馏水加热至沸腾,向沸水中逐滴加入1~2mlFeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确__________。(填“正确”或“不正确”,下同)
②乙向沸水中滴加饱和FeCl3溶液,为了使反应充分进行,煮沸10分钟,请评价是否正确__________。
(2)写出制备Fe(OH)3胶体的化学方程式:_________________________________。
(3)聪明的你还想出来许多在家里观察丁达尔效应的方法,请设计一个你认为最简单、最环保的办法:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
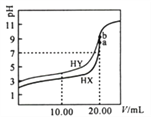
A. 水解常数:X->Y-
B. 10.00mL时,有c(Na+)>c(HX)>c(X-)>c(H+)
C. pH=7时,c(Y-)>c(X-)
D. a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com