
【题目】在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A. c(Na+)==c(CH3COO-)+c(CH3COOH)
B. c(H+)==c(CH3COO-)+c(OH一)
C. c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D. c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:2N2O5(g)![]() 4NO2(g) + O2(g) ΔH=+Q kJmol-1 (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) ΔH=+Q kJmol-1 (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是
A. 在500s内,O2分解速率为3×10-3 molL-1s-1
B. 在1000s时,反应恰好达到平衡
C. 在1000s内,反应吸收的热量为2.5Q kJ
D. 在1500s时,N2O5的正反应速率等于NO2的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在地球上含量丰富,其中氨气在工农业生产生活中有着重要的作用。
(1)大气中氮以_________(填微粒符号)形式存在。固氮是氮循环的重要环节,工业固氮制NH3反应温度选择500℃左右的原因是________________________________。
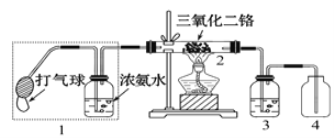
(2)某兴趣小组用如图装置探究氨的催化氧化,加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”)。
(3)上图中若取消3,在4中仅观察到大量白烟,该白烟的化学式可能为______________。
(4)实验室还可用浓氨水与氢氧化钠固体混合,制得氨气。请用平衡移动及其他相关的理论解释该方法能制备氨气的原因:_____________________________________________。
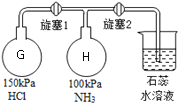
(5)按下图装置进行氨气的性质实验(旋塞1和旋塞2实验前关闭),G、H是两个等体积的容器。先打开旋塞1,一段时间后,关闭旋塞1,再打开旋塞2,H瓶中现象依次是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是( )
A.不能用pH试纸测定浓硫酸和新制氯水的pH
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
D.氢氧化钠固体易潮解和铝制容器可用盛装浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家侯德榜创立了中国的制碱工艺,促进了世界制碱技术的发展。下图是纯碱工艺的简化流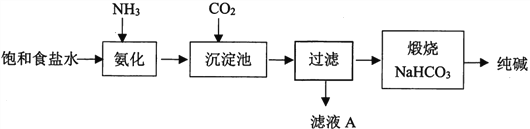
(1)写出CO2的电子式____________________。
(2)用离子方程式表示纯碱工艺中HCO3-的生成___________________。
(3)工业生产时先氨化再通CO2,顺序不能颠倒,原因是_______________。
(4)滤液A中最主要的两种离子是_________。
(5)某小组设计如下实验分离滤液A中的主要物质。打开分液漏斗活塞,一段时间后,试管中有白色晶体生成,用化学原理解释白色晶体产生的原因___________________。

(6)某纯碱样品因煅烧不充分而含少量NaHCO3,取质量为m1的纯碱样品,充分加热后质量为m2,则此样品中碳酸氢钠的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影…”月光穿过薄雾形成的种种美景的本质原因是
A. 光是一种胶体 B. 雾是一种胶体
C. 发生丁达尔效应 D. 空气中的小水滴颗粒直径大小约为1nm~100nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成物总能量高于反应物总能量的是
A. 铁与盐酸反应 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. Ba(OH)2·8H2O 与NH4Cl 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2===2Fe3++2Br-,2Br-+Cl2===Br2+2Cl- , 2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
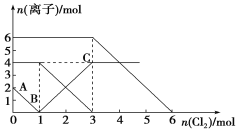
A. 还原性:I->Fe2+>Br-
B. 当通入2 molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D. 原混合溶液中FeBr2的物质的量为6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com