
【题目】古诗词是中华文化的瑰宝。下列诗词、俗语中涉及了化学反应的是( )
A.只要功夫深,铁杵磨成针
B.千里冰封,万里雪飘
C.野火烧不尽,春风吹又生
D.千淘万漉虽辛苦,吹尽狂沙始到金
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
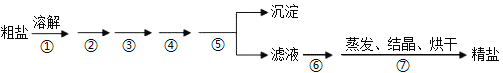
A. 在第①步中使用玻璃棒搅拌可加速粗盐溶解
B. 第⑤步操作是过滤
C. 在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D. 除去MgCl2的离子方程式为:Mg2++2OH=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是( )
A. 镁、铝与沸水不可能反应
B. 铁在一定条件下可以与水反应
C. 钠与水反应的离子方程式:Na+H2O=Na++OH-+H2↑
D. 钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不正确的是( )
A.用托盘天平称取 4.5 g 固体氯化钠B.在烧杯中稀释浓硫酸
C.用温度计代替玻璃棒搅拌溶液D.在蒸发皿中蒸发浓缩食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是Na202和C02定性、定量实验的装置示意图。
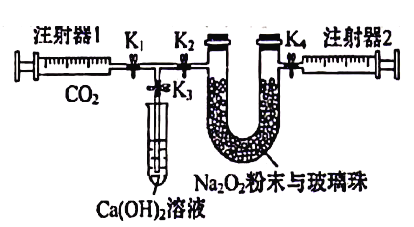
注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动。下列叙述中不正确的是
A. U形管内的玻璃珠可防止过氧化钠粉末被吹和增大过氧化钠和二氧化碳的接触面积
B. U形管内淡黄色粉末渐渐变白
C. 注射器1活塞推到底后,注射器2中收集到的气体大于50mL,只是因为还含有CO2
D. 打开胶塞,立即将带火星的木条伸入U形管中,可验证反应产物之一为氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图 1 所示装置制备 KClO 溶液,并通过 KClO 溶液与 FeCl3 溶液的反应制备高效水处理剂K2FeO4。已知 K2FeO4 具有下列性质: ①可溶于水,微溶于饱和 KOH 溶液;②在 0~5 ℃的强碱性溶液中比较稳定;③在 Fe3+和 Fe(OH)3 催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成 Fe(OH)3 和 O2。
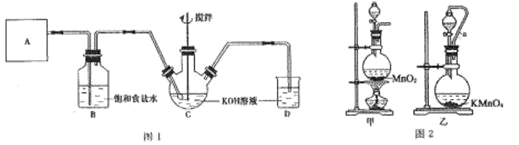
回答下列问题:
(1)装置A 用于产生氯气,若选用图 2 中的甲装置,反应的离子方程式是_____,若选用装置乙,其中的导管 a 的作用是_____。
(2)Cl2 与 KOH 在较高温度下反应生成 KClO3。在不改变 KOH 溶液的浓度和体积的条件下,控制反应在0--5℃进行。实验中可采取的措施是_____;在通入氯气的过程中,不断搅拌的目的是_____。
(3)制备 K2FeO4 时,KClO 饱和溶液与 FeCl3 饱和溶液的混合方式为_____,反应的离子方程式是_____。
(4)提纯 K2FeO4 粗产品[ 含有 Fe(OH)3、KCl 等杂质]的实验方案为:将 K2FeO4 粗产品溶于冷的3 mol/LKOH 溶液中__________(填操作名称),将滤液置于冰水浴中,再加入_________,搅拌、静置、再过滤,晶体用适量乙醇洗涤 2--3 次后,在真空干燥箱中干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com