
【题目】下表为元素周期表的一部分,参照元素①-⑧在表中的位置,请回答下列问题。
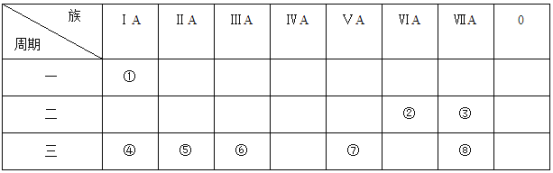
(1)元素③单质的化学式为___________,①和④两种元素形成化合物的电子式为_________。由①②组成且含有非极性键的物质的结构式为____________。
(2)④-⑧5种元素所形成的最高价氧化物的水化物中,碱性最强的是_________,酸性最强的是___________,属于中强酸的是_________(均填化学式)。
(3)④和⑥两种元素的最高价氧化物的水化物,在水中反应的离子方程式为____________。
【答案】 F2 Na+[:H]— H—O—O—H NaOH HClO4 H3PO4 Al(OH)+OH—=AlO2—+H2O
【解析】根据元素在周期表中的位置可知,①为H元素,②为O元素,③为F元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为P元素,⑧为Cl元素,结合元素周期律的内容分析解答。
(1)元素③单质的化学式为F2,①和④两种元素形成化合物为氢化钠,属于离子化合物,电子式为Na+[:H]—。由①②组成且含有非极性键的物质为过氧化氢,结构式为H—O—O—H,故答案为:F2;Na+[:H]—;H—O—O—H;
(2)元素的金属性越强,最高价氧化物的水化物的碱性越强,元素的非金属性越强,最高价氧化物的水化物的酸性越强,④-⑧5种元素所形成的最高价氧化物的水化物中,碱性最强的是NaOH,酸性最强的是HClO4,属于中强酸的是H3PO4,故答案为:NaOH;HClO4;H3PO4;
(3)④和⑥两种元素的最高价氧化物的水化物分别为氢氧化钠和氢氧化铝,氢氧化铝为两性氢氧化物,在水中反应的离子方程式为Al(OH)+OH—=AlO2—+H2O,故答案为:Al(OH)+OH—=AlO2—+H2O。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】某有机化合物M的结构简式如图所示,有关该化合物的叙述不正确的是
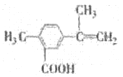
A. 该有机物的分子式为C11H12O2
B. 该有机物的所有碳原子可能处于同一平面上
C. 仅考虑取代基在苯环上的位置变化,M的同分异构体(不包括自身)有9种
D. 该有机物一定条件下只能发生加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3 , 放出92kJ热量。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究____________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________作对比(填序号)。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液 ③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸 ⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂________(填序号),现象______________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
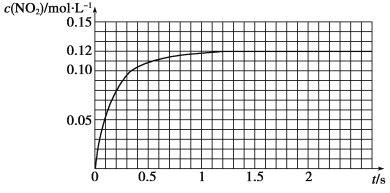
(1)反应容器中最后剩余的物质有______________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1mol H2O的说法正确的是( )
A.含有6.02×1023个氢分子B.含有6.02×2×1023个氢元素
C.质量为18gD.氢原子与氧原子的质量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2C(g) ![]() A(g)+2B(g),已知△H<0,下列判断正确的是( )
A(g)+2B(g),已知△H<0,下列判断正确的是( )
A.仅常温下反应可以自发进行
B.仅高温下反应可以自发进行
C.任何温度下反应均可以自发进行
D.任何温度下反应均难以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。丙烷在室温下燃烧的热化学方程式为。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为;
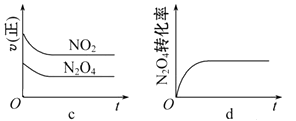
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) ![]() 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1 , 在一定条件下发生反应:A(g)+B(g) ![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为。
②A的转化率为。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH0(填“>”或“<”);若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1 , 此时v(正)v(逆)。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com