
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如图1:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)
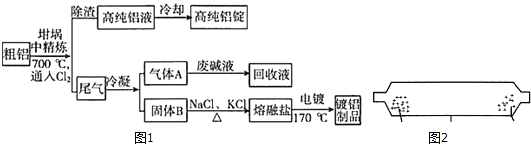
(1)把NaCl和AlCl3的固体混合物置于如图2所示的装置的一端,加热到___(最低温度)℃,即可分离NaCl和AlCl3
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有___;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是___。
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:①H++OH-=H2O,②___
(4)镀铝电镀池中,金属铝为阳极,熔融盐电镀池中存在Na+K+______等离子钢材表面(电极)的电极反应式为AlCl4-+3e-=Al+4Cl-或___
(5)钢材镀铝后,在表面氧化成致密的___,避免钢材接触空气而防止钢材被腐蚀。
【答案】181 H2、HCl、AlCl3 NaCl Cl2+2OH-=Cl-+ClO-+H2O ![]()
![]()
![]() 氧化铝膜
氧化铝膜
【解析】
粗铝![]() 通入氯气在坩埚中精炼,将
通入氯气在坩埚中精炼,将![]() 连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除![]() 外还含有
外还含有![]() 、HCl、
、HCl、![]() ,除渣(氯化钠)后得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为
,除渣(氯化钠)后得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为![]() ,废碱液回收得到回收液;B固体加入氯化钠和氯化钾加热得到熔融盐,电镀得到镀铝制品,据此来分析即可。
,废碱液回收得到回收液;B固体加入氯化钠和氯化钾加热得到熔融盐,电镀得到镀铝制品,据此来分析即可。
(1)![]() 熔点为
熔点为![]() ;
;![]() 在
在![]() 升华,把NaCl和
升华,把NaCl和![]() 的固体混合物置于如图所示的装置的一端,加热到
的固体混合物置于如图所示的装置的一端,加热到![]() 氯化铝升华变为气体,氯化铝气体在另一端冷凝,从而分离了氯化钠和氯化铝;
氯化铝升华变为气体,氯化铝气体在另一端冷凝,从而分离了氯化钠和氯化铝;
(2)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为![]() ,较高,是固态杂质黏附于气泡上,气泡的主要成分除
,较高,是固态杂质黏附于气泡上,气泡的主要成分除![]() 外还含有
外还含有![]() 、HCl、
、HCl、![]() ;
;
(3)根据分析A中有氯气以及氯化氢,均能和烧碱反应,用于尾气处理,因此写出氯气与碱液反应的离子方程式即可:![]() ,氯化氢与碱的反应已经给出;
,氯化氢与碱的反应已经给出;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,熔融盐电镀池中存在![]() 等离子,钢材做阴极得电子,表面
等离子,钢材做阴极得电子,表面![]() 电极
电极![]() 的电极反应式为:
的电极反应式为:![]() 或
或![]() ;
;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的![]() 和
和![]() 的接触,使电化学腐蚀和化学腐蚀不能发生。
的接触,使电化学腐蚀和化学腐蚀不能发生。


科目:高中化学 来源: 题型:
【题目】按要求作答。
(1)①写出MgO的名称________________;②写出乙炔的结构式______。
(2)写出NaHCO3受热分解的化学方程式______________。
(3)写出Cl2与NaOH溶液反应的离子方程式_____________。
(4)海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3,同时还有一种强酸生成,写出该反应的化学方程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.氢键属于一种较强的分子间作用力,只能存在于分子之间
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na<Mg<Al
D.晶格能由大到小:NaF>NaCl>NaBr>Nal
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置图1中A的名称是________,B的名称是_______。A中一般要加入碎瓷片,其作用是________________。装置图4中盛溶液的仪器名称是________。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②步骤③的实验选择上述装置图____(填图的序号)。步骤⑤的实验操作名称是_____,选择上述装置图____(填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_________,选择上述装置图___(填图的序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
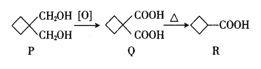
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
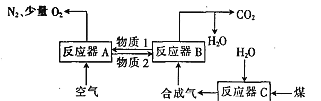
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
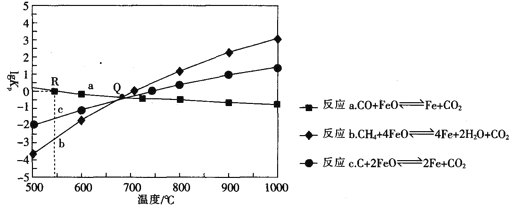
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com