
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
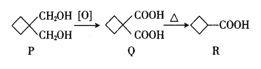
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
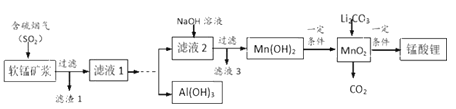
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程_____________
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是_____________(写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目___________。
Fe2++ O2 + H+== Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是_____________和______________。
(5)Cl2的作用是_____________________________。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
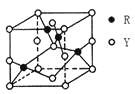
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如图1:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)
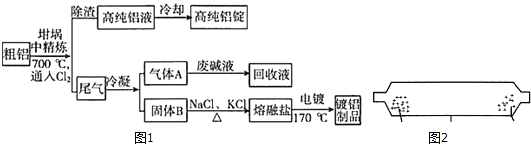
(1)把NaCl和AlCl3的固体混合物置于如图2所示的装置的一端,加热到___(最低温度)℃,即可分离NaCl和AlCl3
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有___;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是___。
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:①H++OH-=H2O,②___
(4)镀铝电镀池中,金属铝为阳极,熔融盐电镀池中存在Na+K+______等离子钢材表面(电极)的电极反应式为AlCl4-+3e-=Al+4Cl-或___
(5)钢材镀铝后,在表面氧化成致密的___,避免钢材接触空气而防止钢材被腐蚀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
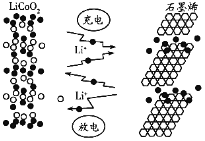
A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、![]() 、Fe3+、
、Fe3+、![]() 、
、![]() 、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
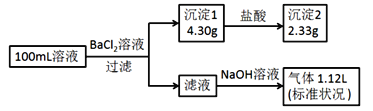
A.原溶液一定存在 ![]() 和
和![]() ,一定不存在 Fe3+
,一定不存在 Fe3+
B.原溶液可能存在 Cl- 和 Na+
C.原溶液中 c(![]() )是 0.01molL-1
)是 0.01molL-1
D.若原溶液中不存在 Na+,则 c(Cl-)<0.1molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
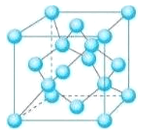
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com