
【题目】居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程_____________
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是_____________(写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目___________。
Fe2++ O2 + H+== Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是_____________和______________。
(5)Cl2的作用是_____________________________。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
【答案】Mg2++2OH-=Mg(OH)2↓ 或 Ca2++CO32-CaCO3↓或 Mg2++CO32-=MgCO3↓ ③ Fe(OH)3 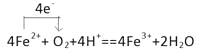 44.8L 除去Ca2+ 调节溶液的酸度 杀菌消毒 2Na+Cl2=2NaCl 2Fe+3Cl2
44.8L 除去Ca2+ 调节溶液的酸度 杀菌消毒 2Na+Cl2=2NaCl 2Fe+3Cl2![]() 2FeCl3等合理均给分
2FeCl3等合理均给分
【解析】
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 其它的属于复分解反应的离子方程式是Mg2++2OH-=Mg(OH)2↓、 Ca2++CO32-CaCO3↓、Mg2++CO32-=MgCO3↓;
(2)凝聚剂除去悬浮固体颗粒的过程,既有物质发生化学反应的过程,也有物质吸附悬浮固体颗粒,使之形成沉淀的过程,因此选项③正确;FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子与溶解在水中的O2会发生氧化还原反应,Fe2+被氧化为Fe3+,O2得到电子,被还原为OH-,反应的离子方程式是:4Fe2++2H2O+O2=4Fe(OH)3↓,因此最终生成胶状沉淀,这种胶状沉淀是Fe(OH)3;
(3)若溶液是酸性溶液,Fe2+被氧化为Fe3+,1个Fe2+失去1个电子,而O2得到电子,被还原变为H2O,1个O2得到4个电子,根据电子守恒及电荷守恒、原子守恒,可得该反应方程式是4Fe2++O2 + 4H+=4Fe3++ 2H2O,用单线桥法表示电子转移是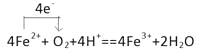 ;根据方程式可知每转移4mol电子,会反应消耗1mol氧气,若转移8mol电子,则反应消耗氧气的物质的量是2mol,其在标准状况下体积为V(O2)=2mol×22.4L/mol=44.8L;
;根据方程式可知每转移4mol电子,会反应消耗1mol氧气,若转移8mol电子,则反应消耗氧气的物质的量是2mol,其在标准状况下体积为V(O2)=2mol×22.4L/mol=44.8L;
(4)在加热絮凝剂的同时通入二氧化碳的目的是与溶液中的Ca2+结合形成CaCO3沉淀,以除去Ca2+;同时与溶液中的OH-发生反应,调节使溶液的pH减小,以增加溶液的酸度;(5)Cl2溶于水,与水发生反应:Cl2+H2O![]() HCl+HClO,反应产生的HClO有强的氧化性,可以对水进行杀菌消毒;(6)Cl2是常用的强氧化剂,一个合理的Cl2作为氧化剂的化学方程式如2Fe+3Cl2
HCl+HClO,反应产生的HClO有强的氧化性,可以对水进行杀菌消毒;(6)Cl2是常用的强氧化剂,一个合理的Cl2作为氧化剂的化学方程式如2Fe+3Cl2![]() 2FeCl3;2NaI+Cl2=2NaCl+I2等。
2FeCl3;2NaI+Cl2=2NaCl+I2等。


科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,若以氢氧化钠溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.正极反应式为![]()
B.负极反应式为![]()
C.电池在工作过程中电解液的碱性保持不变
D.电池工作时,电子通过外电路从正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机盐X(仅含两种元素)可通过单质甲与Ca(OH)2浊夜共热的方法来制备,某同学为探究X的组成和性质,设计了如下实验(流程图 中部分产物已略去)。

已知:气体乙在标况下的密度为1.52 g·L-1,气体丙无色、有刺激性气味,能使品红溶液褪色。
(1)X的化学式为____,乙的电子式为________
(2)X与足量盐酸反应的化学方程式为___________
(3)在澄清石灰水中通入过量气体丙反应的离子方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.氢键属于一种较强的分子间作用力,只能存在于分子之间
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na<Mg<Al
D.晶格能由大到小:NaF>NaCl>NaBr>Nal
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能达到实验目的的是
A. 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 在用稀硫酸和锌粒反应制取氢气时可以适当加热以加快化学反应速率
C. 向煮沸的l mol·L-1 NaOH溶液中滴加FeC13饱和溶液制备Fe(OH)3胶体
D. 称取19.0g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnC12溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
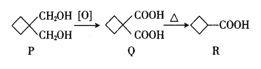
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时生成3amolCB.C的生成速率与C分解的速率相等
C.容器内压强不再变化D.混合气体的物质的量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com