
【题目】无机盐X(仅含两种元素)可通过单质甲与Ca(OH)2浊夜共热的方法来制备,某同学为探究X的组成和性质,设计了如下实验(流程图 中部分产物已略去)。

已知:气体乙在标况下的密度为1.52 g·L-1,气体丙无色、有刺激性气味,能使品红溶液褪色。
(1)X的化学式为____,乙的电子式为________
(2)X与足量盐酸反应的化学方程式为___________
(3)在澄清石灰水中通入过量气体丙反应的离子方程式为____________
【答案】CaS4 ![]() CaS4+2HCl=CaCl2+3S↓ +H2S ↑ SO2+OH-=HSO
CaS4+2HCl=CaCl2+3S↓ +H2S ↑ SO2+OH-=HSO![]()
【解析】
气体乙在标准状况下的密度为1.52gL-1,则Mr(乙)=22.4×1.52=34,乙在O2中燃烧得到无色、有刺激性气味的气体丙,丙可用于漂白纸浆等物质,可推知乙为H2S、丙为SO2。无机盐X(仅含有两种元素)可以通过单质甲与Ca(OH)2浊液共热的方法来制备,由元素守恒可知X中含有两种元素为Ca、S,可知单质甲为S,硫化氢物质的为:2.24L÷22.4L/mol=0.1mol,故16.8g X含有S原子为:0.3mol+0.1mol=0.4mol,则16.8gX中含有Ca原子为:(16.8g-0.4mol×32gmol-1)÷40 gmol-1=0.1mol,故X中Ca、S原子物质的量之比为0.1mol:0.4mol=1:4,则X的化学式为CaS4。
(1)由分析可知,X的化学式为CaS4,乙为H2S,Z的电子式为![]() ,故答案为:CaS4;
,故答案为:CaS4;![]() ;
;
(2)CaS4与足量盐酸反应生成CaCl2、S、H2S,且S、H2S的物质的量之比为3:1,反应的化学方程式为:CaS4+2HCl=CaCl2+3S+H2S↑,故答案为:CaS4+2HCl=CaCl2+3S+H2S↑;
(3)丙为SO2,过量的SO2与石灰水反应生成亚硫酸氢钙,反应的离子方程式为:SO2+OH-=HSO3-,故答案为:SO2+OH-=HSO3-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ能量,根据能量变化示意图,下列说法不正确的是
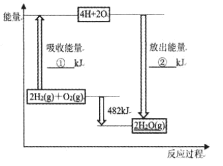
A.①、②的数值分别为1370、1852
B.拆开H2O(g)中的1 molH-O键吸收463kJ的能量
C.2H2(g)+O2(g)=2H2O(g) △H=-482kJ·mol-1
D.已知H2O(1)=H2O(g) △H>0,说明lmolH2O(1)的能量比1molH2O(g)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
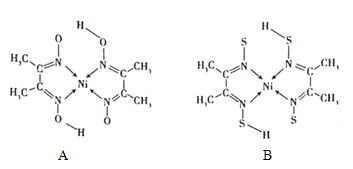
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
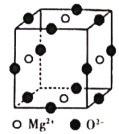
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
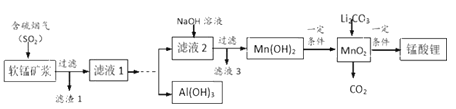
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____,丁中____(填“X”或“Y”)极颜色会加深。
(2)欲用丙装置给铜镀银,H应该是____,电镀液的主要成分是____(填化学式)。
(3)如果收集乙装置中产生的气体,相同条件下两种气体的体积比是___。
(4)甲装置为使用过的铅蓄电池,充电后电极D应与用电器的____(填“正”或“负”)极连接,电极C上的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01x105Pa时,将1L丙烷与若干升O2混合点燃充分燃烧后,恢复至原温度、压强,测得气体体积为aL,通过碱石灰后气体体积变为bL。
(1)若a-b=7, 则bL气体中一定含有____。
(2)若a-b=5,则混合前O2体积是______,点燃前混合气体的平均摩尔质量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.①、②、③的反应类型分别为卤代、水解、消去
C.A能使高锰酸钾酸性溶液褪色
D.A的结构简式是CH2=CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程_____________
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是_____________(写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目___________。
Fe2++ O2 + H+== Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是_____________和______________。
(5)Cl2的作用是_____________________________。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、![]() 、Fe3+、
、Fe3+、![]() 、
、![]() 、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
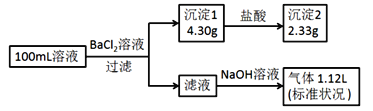
A.原溶液一定存在 ![]() 和
和![]() ,一定不存在 Fe3+
,一定不存在 Fe3+
B.原溶液可能存在 Cl- 和 Na+
C.原溶液中 c(![]() )是 0.01molL-1
)是 0.01molL-1
D.若原溶液中不存在 Na+,则 c(Cl-)<0.1molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com