
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
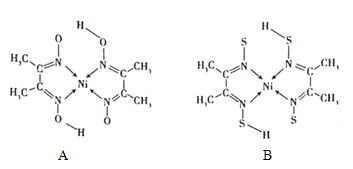
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
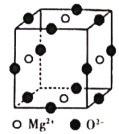
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
【答案】3d N2 CN- sp3和sp2 30NA A分子间存在氢键 ACD 91:6 Mg2NiO3
【解析】
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为3d;
(2)原子数与价电子数分别都相等的互为等电子体;
(3)(1)根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;C-H为碳氢σ键,C-C为碳碳σ键,C=N含有一个碳氮σ键;
(4)①A分子中含有-OH,分子间易形成氢键;
②根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间有氢键;根据碳原子成键类型判断。
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,据此计算x:y;
(6)根据晶胞中原子分摊计算Mg2+、O2-的数目分别为2、3,再根据化合物中化合价代数和为0计算Ni2+的数目。
(1)Ni的原子序数是28,因此基态Ni原子中,电子填充的能量最高的能级符号为3d,故答案为:3d;
(2)原子数与价电子数分别都相等的互为等电子体,则与CO互为等电子体的分子为N2,与CO互为等电子体的阴离子为CN-等;故答案为:N2;CN-;
(3)丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为sp3杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为sp2杂化,分子中含有13个单键,和2个双键,则共含有15个σ键,所以1mol丁二酮肟含有σ键数目为15NA,2mol丁二酮肟含有σ键数目为30NA,故答案为:sp3和sp2;30NA;
(4)①A分子中含有-OH,分子间易形成氢键,B分子不能形成氢键,故答案为:A分子间存在氢键;
②根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选ACD,故答案为:ACD;
(5)设+2、+3两种Ni原子数分别为x,y,则x+y=0.97,2x+3y=2,解得:x:y=91:6,故答案为:91:6;
(6)晶胞中原子分摊得到Mg2+的数目=4×![]() =2,O2-的数目=12×
=2,O2-的数目=12×![]() =3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。
=3,化合物中化合价代数和为0,所以Ni2+的数目为1,所以化学式为Mg2NiO3,故答案为:Mg2NiO3。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对铜、铁与硝酸的反应进行实验探究。回答下列问题:
(1)验证铜与硝酸的反应(实验装置如图所示)。已知仪器a中盛有足量的一定浓度的硝酸溶液,试管b中盛有6.4g铜片。
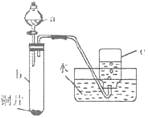
①仪器a的名称是___。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有___。
③待试管b中铜片完全消失。如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是___ g。
(2)探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3molHNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为___。
②Fe粉与稀硝酸反应生成硝酸亚铁的离子方程式为___。
③反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=___。
④标准状况下,生成NO气体的体积为___L(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,若以氢氧化钠溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.正极反应式为![]()
B.负极反应式为![]()
C.电池在工作过程中电解液的碱性保持不变
D.电池工作时,电子通过外电路从正极流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氯、镁、镍、铜是几种重要的元素,请回答下列问题:
(1)镍元素的核电荷数为28,则基态原子的电子排布式为____________________,结构中有__________种不同形状的电子云。
(2)MgO的熔点高于CuO的理由是________________________________________。
(3)镁原子第一电离能反常地高于铝的原因是_____________________________。
(4)Ni与CO能形成配合物![]() ,该分子中
,该分子中![]() 键与
键与![]() 键个数比为__________。
键个数比为__________。
(5) ![]() 分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
分子中的中心原子杂化轨道类型是__________,该分子的空间构型为__________。
(6)铜与氧可形成如图所示的晶胞结构,其中铜原子均匀地分散在晶胞内部,a、b原子的坐标参数依次为(0,0,0)、![]() ,则d原子的坐标参数为____________________,已知:该晶体的密度为
,则d原子的坐标参数为____________________,已知:该晶体的密度为![]() ,
, ![]() 是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。
是阿伏加德罗常数的值,则晶胞参数为__________cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答。
(1)①写出MgO的名称________________;②写出乙炔的结构式______。
(2)写出NaHCO3受热分解的化学方程式______________。
(3)写出Cl2与NaOH溶液反应的离子方程式_____________。
(4)海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3,同时还有一种强酸生成,写出该反应的化学方程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机盐X(仅含两种元素)可通过单质甲与Ca(OH)2浊夜共热的方法来制备,某同学为探究X的组成和性质,设计了如下实验(流程图 中部分产物已略去)。

已知:气体乙在标况下的密度为1.52 g·L-1,气体丙无色、有刺激性气味,能使品红溶液褪色。
(1)X的化学式为____,乙的电子式为________
(2)X与足量盐酸反应的化学方程式为___________
(3)在澄清石灰水中通入过量气体丙反应的离子方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com